
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Гесса(1840)
|
|
|
|
Зако́н Ге́сса — тепловий ефект реакції при постійних об'ємі або тиску (коли відсутня не пов'язана з розширенням робота) не залежить від шляху реакції, а лише від початкового й кінцевого станів системи.не залежить від проміжних стадій
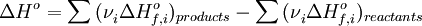
23. Гомогенні і гетерогенні системи. Швидкість хімічних реакцій. Закон діючих мас. Константа швидкості реакції її фізичний зміст.
Гомогенна система (від грец. Ὁμός — рівний, однаковий; грец. γένω — народжувати) — однорідна система, хімічний склад і фізичні властивості якої у всіх частинах однакові або змінюються безперервно, без стрибків (між частинами системи немає поверхонь розділу). У гомогенної системі з двох і більше хімічних компонентів кожен компонент розподілений в масі іншого у вигляді молекул, атомів, іонів. Складові частини гомогенної системи можна відокремити один від одного механічним шляхом.
В гомогенних сумішах складові частини можна знайти ні візуально, ні за допомогою оптичних приладів, оскільки речовини знаходяться в роздробленому стані на мікрорівні. Гомогенними сумішами є суміші будь-яких газів і істинні розчини, а також суміші деяких рідин і твердих речовин, наприклад сплави.
Гетерогенні системи — фізико-хімічні системи, що складаються з двох або кількох фаз, напр., система: «лід — вода —водяна пара» — гетероґенна система з трьох фаз.
Гетерогенна система (від грец. Ἕτερος - різний; γένω - народжувати) - неоднорідна система, що складається з однорідних частин (фаз), розділених поверхнею розділу. Однорідні частини (фази) можуть відрізнятися один від одного за складом і властивостями. Число речовин (компонентів), термодинамічних фаз і ступенів свободи пов'язані правилом фаз. Прикладами гетерогенних систем можуть служити: рідина - насичена пара; насичений розчин з осадом; багато сплавів.
Для гомогенних систем швидкість хімічної реакції визначають як зміну концентрації реагуючих речовин або продуктів реакції за одиницю часу V=+- ΔC/ΔT=+-dc/dt
Швидкість хімічної реакції залежить від природи реагуючих речовин концентрації температури наявності каталізатора
Закон діючих мас
Швидкість хім. Гомогенної реакції пропорційна добутку концентрації реагуючих речовин у степенях які дорівнюють коефіцієнтам у відповідних рівняннях реакції
V=KC2SO4*CCO2
Константа швидкості реакції
Константа швидкості реакції (питома швидкість реакції) - коефіцієнт пропорційності в кінетичному рівнянні.
Фізичний сенс константи швидкості реакції k випливає з рівняння закону діючих мас: k чисельно дорівнюєшвидкості реакції при концентрації кожного з реагуючих речовин дорівнює 1 моль / л.
Константа швидкості реакції залежить від температури, від природи реагуючих речовин, але не залежить від їх концентрації.
V=K(2CSO4)2*CO2
24. Залежність швидкості хімічних реакцій від різних факторів природи реагентів температури тиску.Енергія активації.Гомогенний і гетерогенний каталіз.
Природа реагуючих речовин істотно позначається на їхній реакційній здатності. Дослідімо, приміром, реакції різних металів - цинку, магнію та заліза з хлоридною кислотою. Помістімо у хімічні стакани ошурки цих металів кількістю 0,1 моль кожний і добавмо однакові порції хлоридної кислоти. Про швидкість перебігу кожної з реакцій можна судити за інтенсивністю виділення бульбашок водню. Найшвидше з хлоридною кислотою реагує магній, найповільніше - залізо.
онцентрація реагентів також впливає на швидкість хімічної реакції. Якщо виконати описаний дослід з хлоридною кислотою, розбавленою вдвічі, усі реакції відбуватимуться повільніше. Адже зі зменшенням концентрації реагентів зменшуватиметься частота зіткнень (у тому числі й активних) між їхніми частинками. Зі збільшенням концентрації реагентів зростає кількість зіткнень (активних також) між їхніми частинками.
Зі зростанням тиску швидкість реакції за участю газуватих речовин зростає, бо вміст активних молекул газу в одиниці об'єму (концентрація) збільшується.
• Температура, за якої відбувається хімічна реакція, також позначається на її швидкості. Зі зростанням температури хімічні реакції переважно пришвидшуються. Це зумовлено збільшенням умісту активних молекул (чи інших структурних частинок) у реакційній суміші. Натомість охолодження уповільнює взаємодію між реагентами. Саме тому харчові продукти довше зберігаються за низьких температур.
Енергія активації - запас енергії, необхідний для того, щоб під час зіткнення частинок реагентів зруйнувалися старі й утворилися нові хімічні зв'язки. Взаємна орієнтація у просторі (особливо для багатоатомних молекул складної форми) також впливає на ефективність зіткнень частинок реагентів.
Каталізатор –речовина що збільшує швидкість реакції кількісно і якісно при цьому змінюючись
При гомогенному каталізі всі реагуючі речовини і каталізатор утворюють одну фазу.
При гетерогенному каталізі каталізатор утворює самостійну як правило тверду фазу на поверхні якої відбуваються каталітичні процеси.
25.Оборотні і необоротні реакції.Хімічна рівновага.Константа рівноваги.Зміщення хімічної рівноваги.Принцип ле Шательє.
Необоротні реакції відбуваються тільки в одному напрямі аж до повної витрати одного з реагентів. Реакція горіння магнію (мал. 13.3), приміром, необоротна. Вона триватиме доти, доки не витратиться весь магній або (якщо реакція відбувається у закритій системі) кисень, який підтримує горіння.
Натомість оборотні реакції відбуваються одночасно у двох протилежних напрямах - прямому і зворотному (мал. 17.1):
Н2 + І2= 2HI
Оборотні реакції не йдуть до кінця і закінчуються встановленням хімічної рівноваги — такого стану системи реагуючих речовин, за якого швидкості прямої та зворотної реакцій однакові.
Хімічною рівновагою можна керувати, використовуючи чинники, які впливають на швидкість хімічної реакції
Стан системи в якому швидкість прямої та зворотної реакції однакові називають хімічною рівновагою.
Константа рівноваги залежить від природи реагентів і температури і не залежить від їх вихідних концентрацій.
Принцип ле Шательє
При зміні умов за яких система перебуває в рівновазі рівновага зміщується в напрямку перебігу процесів що протидіють цій зміні
При підвищенні температури хімічна рівновага зміщується в напрямку ендотермічний реакції, при зниженні температури - в напрямку екзотермічної реакції. У загальному ж випадку при зміні температури хімічна рівновага зміщується в бік процесу, знак зміни ентропії в якому збігається зі знаком зміни температури.
Тиск істотно впливає на положення рівноваги в реакціях за участю газоподібних речовин, що супроводжуються зміною обсягу за рахунок зміни кількості речовини при переході від вихідних речовин до продуктів:
При підвищенні тиску рівновага зсувається в напрямку, в якому зменшується сумарна кількість молей газів і навпаки.
У реакції синтезу аміаку кількість газів зменшується вдвічі: N2 + 3H2 ↔ 2NH3
Значить, при підвищенні тиску рівновага зміщується в бік утворення NH3, про що свідчать наступні дані для реакції синтезу аміаку при 400 ° C:
Вплив концентрації на стан рівноваги підпорядковується наступним правилам:
При підвищенні концентрації одного з вихідних речовин рівновагу зсувається в напрямку утворення продуктів реакції;
При підвищенні концентрації одного з продуктів реакції рівновагу зсувається в напрямку утворення вихідних речовин.
Якщо об’єм системи при реакції не змінюється то тиск не впливатиме на стан рівноваги каталізатор прискорює як пряму так і зворотню реакцію і тому не впливає на стан хімічної рівноваги.
26. Щсновні термодинамічні величини внутрішня енергія ентальпія ентропія енергія Гіббса.Фактори що визначають напрям перебігу хімічних реакцій.
Термодинамічні величини (функції чи параметри) — це фізичні величини — характеристики стану системи, які взаємозв'язані в рівняннях стану системи. З деякими з них (тиск, об'єм, температура) ми вже знайомі. Тепер розглянемо складніші, зокрема "внутрішня енергія", "ентальпія", "ентропія", "енергія Гіббса", за допомогою яких формулюються термодинамічні закони.
Перший закон термодинаміки відображає всесвітній закон збереження енергії за перетворення тепла в роботу, і навпаки. Одне з його формулювань: тепло, яке підводиться до системи Q, може витрачатись на збільшення внутрішньої енергії (інтенсивності руху молекул або атомів) системи U і виконання нею роботи.
Якщо система з внутрішньою енергією переходить у стан з внутрішньою енергією, отримуючи із зовнішнього середовища тепло Q, то її внутрішня енергія становитиме. Але, якщо при цьому система виконуватиме роботу А над зовнішнім середовищем, то її внутрішня енергія зменшиться саме на величину А., звідки зміна внутрішньої енергії, а підведене тепло.
Якщо зміна внутрішньої енергії системи, до якої надходить тепло, відбувається практично без зміни її об'єму, отже, без виконання роботи, то член рівняння буде дорівнювати нулю, що має місце за нагрівання твердої речовини чи рідини. Зміна внутрішньої енергії такої системи визначається за формулою:, де — молярна теплоємність; n — кількість молей; — різниця між кінцевою і початковою температурами.
Така термодинамічна функція стану системи існує і називається ентальпією. Вона позначається буквою H і визначається рівнянням:, де p — внутрішній тиск системи (позначається малою літерою на відміну від P для зовнішнього тиску), U — внутрішня енергія системи (руху і взаємозв'язку атомів чи молекул).
Член рівняння pV — енергія системи, яка визначається простором V. Інколи її називають зовнішньою енергією.
Зміна ентальпії визначається рівнянням:
Підставивши замість його значення з виразу першого закону термодинаміки, отримаємо:.
У відкритих природних і хімічних технологічних процесах розширення системи відбувається за внутрішнього тиску системи p, який дорівнює зовнішньому атмосферному P, отже,
Такий самий вираз матиме рівняння зміни ентальпії у системах хімічних реакцій у твердому або рідкому агрегатному стані, де зміни об'єму незначні. Отже, в таких реакціях поглинання чи втрата тепла (чи) дорівнюватиме зміні внутрішньої енергії системи, а зміна ентальпії матиме відповідний знак і. Звернімо увагу, що тепловий екзотермічний ефект реакції відносно ентальпії міняє знак, оскільки система втрачає енергію, а за ендотермічних реакцій навпаки: тепловому ефекту відповідає (система поглинає енергію).
Ві́льна ене́ргія Гі́ббса (або просто ене́ргія Гі́ббса, або потенціа́л Гі́ббса, або термодинамі́чний потенціа́л у вузькому значенні) — це термодинамічний потенціалтакого вигляду:
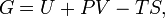
Енергію Гіббса можна розуміти як повну хімічну енергію системи (кристала, рідини тощо)
Поняття енергії Гіббса широко використовується в термодинаміці та хімії.
Під час ізохорного процесу коли система не виконує зов робити пов’язаної із зміною об’єму вся теплота що виділяється або поглинається призводить до зміни внутрішньої енергії
U1-U2=ΔU=QV
Під час ізобарного процесу крім зміни внутрішньої енергіїΔU в системі за рахунок зміни обєму виконується робота яка дорівнює добутку тиску P на зміну обєму в системі ΔV
ΔU+p*ΔV=ΔH=QP
27.Загальна характеритика розчинів.Хімічні і фізичні процеси при розчинені.Теплота розчинення.Закон Генрі.
Рóзчини (рос. раствор, англ. solution, нім. Lösung f) — цілком однорідні суміші з двох (або кількох) речовин, в яких молекули (або іони) одної речовини рівномірно розподілені між молекулами другої речовини.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 967; Нарушение авторских прав?; Мы поможем в написании вашей работы!