
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура. Реакция Вильсмейера — Хаака [ править | править исходный текст ] Реакція Вильсмейера - Хаака
|
|
|
|
Реакция Вильсмейера — Хаака [ править | править исходный текст ] Реакція Вильсмейера - Хаака
Реакция Бутлерова [ править | править исходный текст ] Реакція Бутлерова
англ. Butlerov reaction или англ. Formose reaction англ. Butlerov reaction або англ. Formose reaction
Основная статья: Реакция Бутлерова
Автокаталитическая реакция синтеза различных сахаров из формальдегида в слабощелочных водных растворах в присутствии ионов металлов, например кальция.Автокаталітична реакція синтезу різних цукрів з формальдегіду в слаболужних водних розчинах в присутності іонів металів, наприклад кальцію.
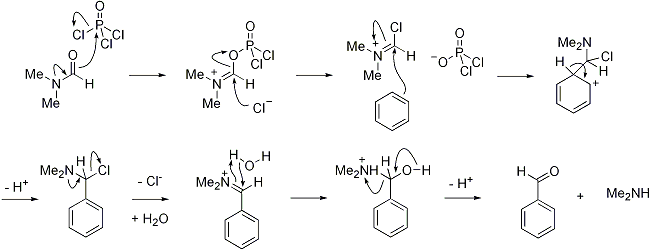
Один из способов введения карбонильной группы в ароматическое кольцо. Один із способів введення карбонільної групи в ароматичне кільце. Реакция состоит из двух стадий — образование реагента Вильсмейера — Хаака и его присоединения к кольцу. Реакція складається з двох стадій - утворення реагенту Вильсмейера - Хаака і його приєднання до кільця. Реагент представляет собой слабый электрофил. Реагент представляє собою слабкий електрофіл. Поэтому реакция лучше протекает с электронообогащенными карбо- и гетероциклами. Тому реакція краще протікає з електронозбагачених карбо-і гетероциклами.
KNO3 — нітрат калію (азотнокислий калій)
CaSO4 — сульфат кальцію (сірчанокислий кальцій),
Na3PO4 — фосфат натрію (фосфорнокислий натрій),
BaCO3 — карбонат барію (вуглекислий барій),
Na2SiO3 — силікат натрію (кремнекислий натрій
1. При заміщенні атомів Гідрогену в молекулах кислот на атоми металів Способи добування
2Fe + 6HCl = 2FeCl3 + 3H2
2C3H5(COOH)3 + 3CuO = [C3H5(COO)]2Cu3 + 3H2O
2. При обміні гідроксильних груп у молекулах основ на кислотні залишки молекул кислот.
HCl + NaOH = NaCl + H2O
CH3COOH+ NaOH = CH3COONa + H2O
3. При взаємодії кислот з основними оксидами:
2HCl + CuO = CuCl2 + H2O
4. При взаємодії кислот з амфотерними оксидами:
3H2SO4 + Al2O3 = Al2(SO4)3 + 3H2O
5. При взаємодії кислот з солями:
3H2SO4 + Ca3(PO4)2 = 2H3PO4 + 3CaSO4 ↓
6. При взаємодії кислот з металами:
2HCl + Zn = ZnCl2 + H2 ↑
7. При взаємодії основ з кислотними оксидами:
2KOH + CO2 = K2CO3 + H2O
8. При взаємодії основ з солями:
2NaOH + CuCl2 = 2NaCl + Cu(OH)2 ↓
9. При взаємодії основних оксидів з кислотними:
CaO + CO2 = CaCO3
10. При взаємодії солей:
K2SO4 + BaCl2 = 2KCl + BaSO4 ↓
11. При взаємодії солей з металами:
CuSO4 + Zn = ZnSO4 + Cu
12. При взаємодії металів з неметалами:
Mg + Cl2 = MgCl2
Властивості
Усі солі являють собою тверді кристалічні речовини. По відношенню до нагрівання деякі солі є досить стійкими. Наприклад: NaCl, KCl, Na2SO4 тощо. Ці солі можна нагрівати до температури їх плавлення і навіть кипіння, і вони не розкладаються. Інші ж солі нестійкі і при нагріванні розкладаються, не плавлячись. Наприклад:
За розчинністю у воді солі поділяють на добре розчинні, малорозчинні і практично нерозчинні.
1. Солі можуть взаємодіяти з кислотами лише в тому випадку, коли реагуюча кислота сильніша за ту, від якої походить дана сіль. Наприклад:
FeS + 2HCl = FeCl2 + H2S ↑ Na2SiO3 + Н2SO4 = Na2SO4 + H2SiO3 ↓
2. Солі можуть взаємодіяти з лугами, коли внаслідок реакції утворюється нерозчинна основа або нерозчинна сіль.
FeCl3 + 3NaOH = 3NaCl + Fe(OH)3 ↓
K2CO3 + Ba(OH)2 = 2KOH + BaCO3 ↓
3. Розчини солей можуть взаємодіяти з металами, коли даний метал в електрохімічному ряду напруги стоїть лівіше від металу солі. Наприклад:
CuSO4 + Fe = FeSO4 + Cu HgCl2 + Cu = CuCl2 + Hg
4. Багато солей у розчинах можуть взаємодіяти одна з одною, коли одна із солей, що утворюється внаслідок реакції, є нерозчинною.
Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓
FeSO4 + BaCl2 = FeCl2 + BaSO4 ↓
Взаємне перетворення солей
СaCO3+H2O+CO2=Ca(HCO3)2
CuSO4+CaOH=CaCO3+H2O
9.Корпускулярно-хвильова двоїстість електрона.Рівняння де Бройля.
Корпускуля́рно-хвильови́й дуалі́зм — запропонована Луї де Бройлем гіпотеза про те, що будь-яка елементарна частка має хвильові властивості, а будь-яка хвиля має властивості, характерні для частинки.
Гіпотеза де Бройля з'явилася тоді, коли стало відомо, що електромагнітні хвилівипромінюються й поглинаються порціями — квантами (див. абсолютно чорне тіло,фотоефект). Тобто, хвилі демонструють властивості, які раніше приписувалися лише частинкам (корпускулам).
Де Бройль висловив гіпотезу, що справедливе обернене твердження: будь-якаелементарна частинка має також хвильові властивості. Він оцінив довжину хвилі частинки, виходячи з енергетичних міркувань. Якщо електромагнітна
хвиля з частотою ν має енергію 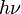 , де h — стала Планка, то схожим чином можна визначити також частоту (а отже, й довжину хвилі) інших частинок, наприклад, електронів.
, де h — стала Планка, то схожим чином можна визначити також частоту (а отже, й довжину хвилі) інших частинок, наприклад, електронів.
Енергія частинки згідно з положеннями теорії відностності залежить від її маси. Тоді для визначення довжини хвилі де Бройля λ можна скористатися співвідношенням
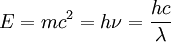 .
.
Гіпотеза де Бройля знайшла підтвердження, коли в 1925 р. Ервін Шредінгер використав її для запису хвильового рівняння.
Експериментальне відкриття в 1927 р. явища дифракції електронів остаточно підтвердило справедливість коспускулярно-хвильового дуалізму.
Рівняння де Бройля
Кожній частинці з масою m що рухається з швидкістю v властиве електромагнітне коливання
λ=h/mV h-СТАЛА ПЛАНКА
10.Енергетичний стан електрона в атомі.Квантові числа.Принцмп Пауля.
Енергетичний стан електрона в атомі характеризується 4 квантовими цифрами.
Атомна орбіталь- це область простору в якій імовірність перебування електрона становить 90%
n -головне квантове число визначає розміри АО та енергію електрона що на ній знаходиться воно набуває значень цілих чисел від1до нескінченності кожному з його значень відповідає певний рівень енергії або енергетичний рівень.
Максимальна кількість електронів на певному енергетичному рівні
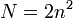 .
.
l- орбітальне квантове чило характеризує енергію електрона на підрівні форму а.о. може мати значення від 0 до n-1
кількість електронів на підрівні N`=2(2l+1)
Підрівень -одна або декілька орбіталей з однаковими значеннями l i n
n=1 l=0(1s) n=2 2s 2p n=3 3s 3p 3d
m -магнітне квантове число характеризується напрямленістю а.о. в просторі приймає значення від-l до +l
l=1 m=-1,0,+1 m=2l+1 l=2 m=-2,-1,0,+1,+2
Набір значень трьох квантових чисел n,l,m визначає енергію електрона та розміри форму і орієнтацію а.о. на якій він знаходиться.Кожну орбіталь іноді зображають як енергетичну комірку у виляді квадрата.
s- спінове квантове чмсло
При проходженні через магнітне поле змінної напруги потік електронів поділяється на два потоки.Це означає що електрони поводять себе як мікромагніти отже електрони мають власні магнітні моменти які називають спіновими. спіни електронів напрямлені в один бік називають паралельними в протилежні-антипаралельні(спарені)
Значення 4 квантових чисел характеризують сукупність складних рухів електронів в атомі але тільки принцип Паулі дає змогу визначити такі комбінації квантових чисел які відповідають реальному розподілу електронів в атомі.В атомі не може бути двох електронів з однаковими значенями всіх 4 квантових чисел.
11. Будова електронних оболонок атомів. Принцип мінімальної енергії. Послідовність атомних орбіта лей електронами. Правило Клечковського (на прикладах).
Електронною будовою(конфігурацією) називають розподіл електронів по енергетичних рівнях підрівнях та а.о. в не збудженому атомі цей розподіл підкоряється ряду правил.
Принцип мінімальної енергії. В основному стані атома його електрони перебувають на а.о. з мінімальною енергією
¹H 1S ²He 1s²
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 505; Нарушение авторских прав?; Мы поможем в написании вашей работы!