
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Друге правило Кличковського
|
|
|
|
Перше правило Кличковського
Послідовне заповнення а.о. електронами відбувається від а.о. з меншою суммою чисел (n+l) до а.о. з більшою суммою цих чисел.
Підрівні 1s 2s 2p 3s
(n+l) 1+0=1 2+0=2 2+1=3 3+0=3
3Li 1s22s1
Заповнення а.о з однаковою сумою n+l відбувається від а.о. з меншим значенням n до а.о. з більшим значенням цього числа.
E3p<E3s
5Be 1s22s22p1
12. Періодичний закон та періодична система Д.І.Менделєєва.Структура періодичної системи її обґрунтування з точки зору будови атома.
Періодичний закон- властивості хімічних елементів та їх сполук знаходяться в періодичній залежності від заряду атомних ядер.
Періодична система -графічний вираз періодичного закону (відомо понад 100 варіантів)
Період- це горизонтальний ряд в якому елементи розміщені в порядку зростання їх атомних мас. починається лужним металом і закінчується інертним газом.Перші три періоди короткі елементикоротуих періодів називають типовими.
4-6 періоди догі вони розміщенні в два ряди 7 період незакінчений.
Групи-це вертикальні колонки елементів створені внаслідок розміщення періодів один над другим.
Типові елементи та їх аналоги з двох періодів утворюють головні(А) іпідгрупи а елементи які не ають анологи в коротких періодів утворюють побічні (В) підгрупи.
12.s- p- d- f- електронні сімейства елементів залежність їх властивостей від електронної будови атомів
В залежності від того який підрівень ав атомах елемента заповнюється електронами останнім відносять до s- p- d- f- елементів
Періодично повторюються подібні елементи внаслідок періодичного повторення подібної електронної конфігурації їх атомів.
Атомним радіусом елемен - вважають пів відстані між ядрами його атомів у простій речовині
Напрям зменшення атомних радіусів елементів ПС. В межах періодів з ростом атомних номерів елементів число електроних оболонок в їх атомах не змінюється а зростання заряду ядер приводить до до підсилення притягання електронів до ядра внаслідок чого атомні радіуси зменшуються
В межах підгруп з ростом атомних номерів елементів зростає число електронних оболонок в їх атомах і атомні радіуси зростають
Втративши 1 чи більше електронів нейтральний атом перетворюється в позитивно заряджений шон –катіон приєднавши електрони негативна заряджений аніон
Втрата атома чи іона електрона призводить до зменшення його радіуса а приєднання до збільшення
Хімічні властивості елемента характеризуються здатністю йога атомів віддавати чи притягувати електрони.
14.Енергія йонізації спорідненість до електрона електронегативність.Періодичність зміни властивостей елементів та її причини.
Енергія іонізації елемента- це енергія необхідна для відриву електрона від не збудженого атома цього елемента
Е0+I=E++e-
Спорідненість елемента до електрона (F)
Енергія що виділяється внаслідок приєднання електрорна не збудженим атомом.
E0+e-=E-+F
Електронегативність елемента (EH)
Здатність його атомів притягувати електронну густину при утворенні хімічних зв’язків EH+1/2(Z+F)
15.Типи хімічних звязків
При взаємодії атомів між собою між ним може виникати хім. Зв'язок який приводить до утворення стійкої систем молекул.хімічний зв'язок виникає за рахунок взаємодії електронних полей електронів і ядер взаємодіючих атомів (природа хімічного зв’язку електрохімічна)
Умовою утворення хім. Зв’язку є зменшення потенціальної енергії системи взаємодіючих атомів.
· Полярний зв'язок
· Ковалентний зв'язок
· Йонний зв'язок
· Металічний зв'язок
Полярний зв'язок — вид хімічного зв'язку, що характеризується наявністю сталого електричного дипольного моментувнаслідок незбігу центрів тяжіння негативного заряду електронів і позитивного заряду ядер. Більшість ковалентних, а також усі донорно-акцепторні та іонні зв'язки є полярними. Молекули, в яких атоми зв'язані полярним зв'язком, називають полярними, наприклад Н2О, NН3, НСl. Такі молекули часто більш реакційноздатні, ніж неполярні.
Ковалентний зв'язок є формою хімічного зв'язку, характерною особливістю якого є те, що задіяні атоми поділяють одну чи більше спільних пар електронів, що і спричиняють їх взаємне притяжіння, яке утримує їх у молекулі. Електрони при цьому, як правило, заповнюють зовнішніелектронні оболонки задіяних атомів. Ковалентний зв'язок найчастіше виникає між атомами із схожою високою електронегативністю. Ковалентний зв'язок найчастіше виникає між неметалами, тоді як іонний зв'язок є найпоширенішою формою зв'язку між атомами металів та неметалів.
Іо́нний хімі́чний зв'язо́к, також йонний хімічний зв'язок [1] — це тип зв'язку, при якому електрони переходять із одного атомадо іншого, й основний вклад в притягання вноситься електростатичною взаємодією.
Утворюється між атомами або групами атомів зі значною різницею в електронегативностях.
Характерний для сполук металів з найтиповішими неметалами.
Кристалічні тверді тіла, утворені завдяки йонному зв'язку, називаються іонними кристалами. Прикладом такого кристалу єкам'яна сіль NaCl
Металі́чний зв'язо́к — тип хімічного зв'язку, при якому валентні електрони атомівделокалізуються і починають взаємодіяти з атомними остовами усього тіла.
16. Ковалентний зв'язок. Уявлення про механізм утворення ковалентного зв’язку σ,π – зв’язки (на прикладах утворення молекул водню та азоту)
Ковалентний зв'язок є формою хімічного зв'язку, характерною особливістю якого є те, що задіяні атоми поділяють одну чи більше спільних пар електронів, що і спричиняють їх взаємне притяжіння, яке утримує їх у молекулі. Електрони при цьому, як правило, заповнюють зовнішніелектронні оболонки задіяних атомів. Ковалентний зв'язок найчастіше виникає між атомами із схожою високою електронегативністю. Ковалентний зв'язок найчастіше виникає між неметалами, тоді як іонний зв'язок є найпоширенішою формою зв'язку між атомами металів та неметалів.
Ковалентний хім. Зв'язок утворюється за рахунок
Ковалентний неполярний зв'язок
При взаємодії атомів з однаковою електронегативністю утворяться молекули з ковалентним неполярним зв'язком. Такий зв'язок існує в молекулах наступних простих речовин: H2, F2, Cl2, O2, N2. Хімічні зв'язки в цих газах утворені за допомогою спільних електронних пар, тобто при перекритті відповідних електронних хмар при зближенні атомів. Складаючи електронні формулиречовин, потрібно пам'ятати, що кожна спільна електронна пара — це умовне зображення підвищеної електронної густини, що виникає внаслідок перекриття відповідних електронних хмар.
Ковалентний полярний зв'язок
При взаємодії атомів, значення електронегативностей яких відрізняються, але не різко, відбувається зміщення загальної електронної пари до більш електронегативного атома. Це найпоширеніший тип хімічного зв'язку, який зустрічається як в неорганічних, так і органічних сполуках. До ковалентних зв'язків в повній мірі відносяться і ті зв'язки, які утворені по донорно-акцепторному механізму, наприклад в іонах гидроксонія і амонія.
Ковалентнтний зв'язок характеризується насиченістю напрямленістю і полярністю
H·+·H=H: H
17 .Способи утворення ковалентних зв’язків. Максимальна ковалентність елементів (на прикладах F,O,S,N)
Ковалентний хім. Зв'язок утворюється за рахунок:
1.Неспарених електронів за норм мтаном атома
2. неспарених електронів у збудженому стані атома.
3.за рахунок неподільної електронної пари одного атома донора і вільної орбіталі атома іншої –акцептора.
Цей зв'язок має назву донорно-акцепторний.
Збільшення валентності атомів у яких не моє вільних АО нам валентних енергетичних рівнях відбувається за рахунок донорно-акцепторного способу утворення ковалентних зв’язків на прикладі атому нітрогену в молекулі аміаку са\ на валентному рівні крім трьох чпільних одну неродільну зв’язуючи електронну пару доякої можуть приєднуватися атоми або йони в результаті приєднання неподільна пара стоє спільною для обох атомів у обох утворюється стабільна електронна оболонка
Максимальна валентність елемента не може перевищувати число АОна валентних енергетичних рівнях їх атомів.
У молекулі аміаку з восьми зовнішніх електронів атома Нітрогену шість утворюють три ковалентні зв'язки і є загальними для атомів нітрогену і гідрогену. Проте два електрони належать тільки атому нітрогену і називаються неподіленою електронною парою. Така пара електронів також може брати участь в утворенні ковалентного зв'язку з іншими атомами, якщо останні мають на зовнішньому енергетичному рівні вільну орбіталь. Вільну 1s-орбіталь має, наприклад, іон гідрогену Н+. Тому при взаємодії молекули аміаку з іоном гідрогену між ними виникає ковалентний зв'язок за рахунок неподіленої електронної пари атома нітрогену і вільної орбіталі іона гідрогену. При цьому утворюється іон амонію NН4+: Такий механізм утворення ковалентного зв'язку називається донорно-акцепторним. Атом, який віддає свою неподілену електронну пару для утворення зв'язку (атом Нітрогену), називається донором, атом, який має вільну вакантну орбіталь і приймає електронну пару, називається акцептором (йон Гідрогену) Завдяки донорно-акцепторному механізму збільшуються валентні можливості атомів. Валентність елемента, таким чином, визначається не тільки числом неспарених електронів, а й наявністю неподілених електронних пар і вільних орбіталей на валентному енергетичному рівні. Отже, в загальному вигляді валентність (ковалентність) елемента визначається числом орбіталей, які використовуються при утворенні хімічного зв'язку (метод ВЗ). Донорно-акцепторний механізм утворення ковалентного зв'язку має особливо велике значення при утворенні координаційних сполук.
18.Направленість ковалентних зв’язків та будова молекул.Дипольні моменти зв’язків і молекул (на прикладах H2 Cl2 HCl H2O NH3 CH3 NH4 CO2)
Відповідно до методу ВЗ хімічний зв'язок між атомами зумовлюється перекриванням s-, р-, d- і f-орбіталей, які (крім s-орбіталі) мають напрямленість у просторі. Тому і хімічний зв'язок, який утворюється за їх участю, має в просторі певну напрямленість. Оскільки електронні орбіталі мають різну форму, то їхнє взаємне перекривання може здійснюватись різними способами. Залежно від способу перекривання електронних орбіталей розрізняють σ- (сигма), π- (пі)і δ- (дельта) зв'язки (рис.6). Сигма-зв'язок (σ-зв'язок) здійснюється при перекриванні електронних орбіталей вздовж лінії, яка з'єднує два ядра. Він може утворюватись за рахунок двох s-електронів, одного s- і одного р-електрона, двох р-електронів, двох d-електронів. Сигма-зв'язок характеризується однією областю перекривання електрон-них орбіталей, він завжди одинарний, тобто утворюється за рахунок однієї електронної пари (рис.7). Пі-зв'язок (π-зв'язок) виникає при перекриванні електронних орбіталей по обидва боки від лінії, яка з'єднує ядра атомів. Цей зв'язок може утворитись при взаємодії двох електронних орбіталей з двома областями перекривання за рахунок двох р-орбіталей і двох d-орбіталей. Пі-зв'язок, наприклад, виявляється в молекулі азоту. На рис. 8,а показано розміщення у просторі р-орбіталей в двох атомах Нітрогену. В молекулі азоту рх-орбіталі утворюють один σ-зв'язок (див. рис.8,б). При утворенні зв'язку рz-орбіталями (див. рис.8,в) і ру-орбіталями виникають π-зв'язки. Отже, в молекулі азоту з трьох зв'язків один – σ-зв'язок, а два інші – π-зв'язки. Хімічний зв'язок, утворений більш ніж одною електронною парою, називається кратним. Підвищення кратності зв'язку приводить до зміцнення міжатомного зв'язку і зменшення між'ядерної відстані (довжини зв'язку). Наприклад, енергія дисоціації молекул фтору F2 і азоту N2 відповідно дорівнює 159 і 946 кДж/моль. У молекулах С2Н6 (Н3С–СН3), С2Н4 (Н2С=СН2) і С2Н2 (НСºСН) відстань між ядрами атомів вуглецю з підвищенням кратності зв'язку зменшується і відповідно дорівнює: 0,1543; 0,1353 і 0,1205 нм. Дельта-зв'язок (δ-зв'язок) зумовлений перекриванням усіх чотирьох пелюсток d-електронних орбіталей, розміщених у паралельних площинах. Хімічний зв'язок утворюється тоді, коли орбіталі, які перекриваються, мають однакову симетрію відносно лінії зв'язку. З умов симетрії випливає, що електрони s-орбіталей можуть брати участь лише в утворенні σ-зв'язків, електрони р-орбіталей – в утворенні σ- і π-зв'язків, а електрони d-орбіталей – в утворенні σ-, π- і δ-зв'язків.
Дипольні моменти утворюються за рахунок водневого зв’язку.за рахунок різніці електронегативності між атомом гідрогену та електронегативності іншої молекули утворюється диполь.диполь двох або кількох полярних молекул взаємодіють один з одним утворюючи водневий зв'язок.Виникнення таких звязків пов’язано з донорно-акцепторною взаємодією молекул завдяки цим зв’язкам зв’язані молекули об’єднуються і утворюють асоціати.
19.Йонний хімічний зв'язок.Будова і властивості йонних сполук.
Зв'язок який утворюється за рахунок взаємодії електростатичного притягання між йонами називають йонним. Всі сполуки знаходяться в кристалічному стані добре розчинні у воді в йонних сполуках електростатичне поле кожного йона поширюється в усіх напрямках в кристалі таму йонний хім. Зв'язок характеризуєтьсяненасиченістю і ненапрямленість. Високою температурою плавлення і кипіння.
Іо́нний хімі́чний зв'язо́к, також йонний хімічний зв'язок [1] — це тип зв'язку, при якому електрони переходять із одного атомадо іншого, й основний вклад в притягання вноситься електростатичною взаємодією.
Утворюється між атомами або групами атомів зі значною різницею в електронегативностях.
Характерний для сполук металів з найтиповішими неметалами.
Кристалічні тверді тіла, утворені завдяки йонному зв'язку, називаються іонними кристалами. Прикладом такого кристалу єкам'яна сіль NaCl. До йонних кристалів належать також численні оксид.
20. Окислення івідновлення.Ступінь окислення елементів.Окисно-відновні реакції складання рівнянь ОВР.
Окиснення (рос. окисление) – хімічний процес, під час якого елемент (або сполука) втрачає електрони, при цьому ступінь окислення її елементів підвищується (див. Окиснення). За іншим тлумаченням, окислення — реакція окисника з відновником(субстратом), наслідком якої є утворення кислот чи кислотних ангідридів. У початковому значенні термін застосовувався виключно до хімічних реакцій з утворенням кислот чи ангідридів, а гіпотетичний елемент, відповідальний за посилення кислотних властивостей, було названо «кисень» (чи, точніше, «оксиген» — той, що породжує кислоту). З часом, однак, термін поширився й на хімічні реакції, що відбувались без утворення кислот чи без участі кисню.
Відновлення (рос. восстановление, англ. reduction; нім. Reduktion f) —- це процес приєднання електронів речовиною, при цьому ступінь окиснення її елементів знижується.
Ступінь окиснення -це умовний заряд який мав би атом коли електрони всіх його зв’язків з іншими атомами були зміщені до більш електронегативного атома.
О́кисно-відно́вна реа́кція (заст. оки́снювально-відно́вна реа́кція) — хімічна реакція, яка відбувається зі зміною ступеня окиснення атомів, що входять до складу реагентів, і реалізується перерозподілом електронів між атомом-окисником таатомом-відновником.
У процесі окисно-відновної реакції відновник віддає електрони, тобто окиснюється; окисник приєднує електрони, тобто відновлюється. Причому будь-яка окисно-відновна реакція являє собою єдність двох протилежних перетворень — окиснення тавідновлення, що відбуваються одночасно та без відриву одне від одного.
21. Окисники відновники.Найважливіші окисники і відновники їх застосування.
Речовина до складу якої входить елемент що окислюється називають відновником а речовина що містить елемент який відновлюється відновником.
Окисни́к (рос. окислитель, англ. oxidazing agent) — атом, молекула чи іон, які в ході хімічної реакції здатні отримувати електрони від відновника.
Відно́вник — речовина, до складу якої входять атоми, що під час хімічної реакції віддають електрони, тобто є донорами електронів.
До окисників належать Fe2 O2(O3) Br2 Cl2 та сполуки до складу яких входять атоми елементів що перебувають у вищих ступенях CO KMnO4 K2Cr2O2 HNO3 H2SO4
До відновників належать речовини здатні втрачати електрони метали водень вуглець та сполуки низьких СО H2S NH3 HCl CH4
22.Енергетичний ефект хімічних реакцій.Термохімічні рівняння.Закон Гесса
Хімічні реакції завжди супроводжуються виділенням або поглинанням енергії. Кількість виділеної або поглиненої енергії називається тепловим ефектом хімічної реакції (Q). Реакції, що супроводжуються виділенням енергії, називаються екзотермічним и, поглинанням енергії, — ендотермічним и.
Хімічні рівняння, в яких наводяться теплові ефекти хімічних реакцій, називаються термохімічним и
Під час хім. Перетворень відбувається зміна внутрішньої енергії реагуючих речовин.
Реакції які супроводжуються виділенням тепла називають екзотермічними CaO+H2O=Ca(OH)2+Q ΔH<O
Реакції які супруводжуються поглинанням енергії тепла –ендотермічні.
N3+O2=2NO-Q ΔH>O
Тепловий ефект реакції завжди відносять до певного числа моль реагуючих речовин.Відповідаючих коефіцієнтом в рівнянні реакції
Термохімічними рівняннями називають таку форму запису реакції в якій одночасно з хім. Символами зазначено також тепловий ефект реакції.у термодинаміці для екзотермічних процесів ΔH<O для ендотермічних ΔH>O
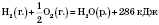
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 730; Нарушение авторских прав?; Мы поможем в написании вашей работы!