
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адсорбція — здатність одних речовин утримувати
|
|
|
|
Вуглець
Хлор
Фосфор
Азот
Бор
Сірка
Водень
Застосування неметалів
виробництво амоніаку, хлоридної кислоти, метанолу, перетворення рідких жирів на тверді, зварювання та різання тугоплавких металів, відновлення металів з руд
одержання сульфатної кислоти, виготовлення гуми з каучуку, виробництво сірників і чорного пороху, виготовлення лікарських препаратів
складова нейтронопоглинаючих матеріалів ядерних реакторів, захист поверхонь сталевих виробів від корозії, у напівпровідниковій техніці, виготовлення перетворювачів теплової енергії в електричну
газуватий — для виробництва амоніаку, створення інертного середовища при зварюванні металів, у вакуумних установках, електричних лампах; рідкий — як холодоагент у моро зильних установках, медицині
білий — для виробництва червоного фосфору; червоний — для виробництва сірників
Силіцій (кремній)
в електроніці й електротехніці для виготовлення схем, діодів, транзисторів, фотоелементів, виготовлення сплавів
виробництво хлоридної кислоти, багатьох органічних розчинників, ліків, мономерів для виробництва пластмас, відбілювачів; як дезінфікуючий засіб
графіт — ливарне, металургій не, радiотехнiчне виробництво; виготовлення акумуляторів; адсорбція; у нафтогазодобувній промисловості для проведення бурових робіт; виготовлення антикорозійних покриттів; різних змазок, що зменшують силу тертя; алмаз — виго товлення інструментів для буріння й різання, абразивний матеріал, ювелірні прикраси.
на своїй поверхні частинки інших речовин.
^ Водневі сполуки неметалів
Водневими сполуками називають бінарні сполуки Гідрогену з іншими хімічними елементами. Водневі сполуки неметалів можна розділити на такі групи: а) сполуки, що розчиняються в воді без гідролітичного розкладу; б) сполуки, що розкладаються водою; в) сполуки, які з водою не взаємодіють.
Максимальна кількість атомів Гідрогену, які можуть входити в склад таких водневих сполук, визначається кількістю вакантних місць на зовнішньому енергетичному рівні неметалу. Таким чином, в водневих сполуках неметал проявляє властивий йому найнижчий негативний ступінь окиснення, наприклад:
| NН3 | Н2O | HF |
| PН3 | Н2S | HCl |
| Н2Se | HBr | |
| НІ |
Отже, кількість атомів Н в молекулах таких водневих сполук збільшується в періоді справа наліво. Електронна будова молекул водневих сполук другого періоду:
Н Н  Н Н Н Н
| Н 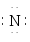 Н Н Н Н
|  Н Н Н Н
| Н 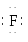
|
| метан | аміак | вода | фторо-водень |
Атоми в молекулах зв’язані ковалентним полярним або слабо полярним (СН4, PН3) зв’язком. Полярність зв’язку в молекулах водневих сполук в періоді посилюється зліва направо, а в підгрупі – знизу вгору. Енергія зв’язку атомів в молекулі збільшується в тому ж напрямку. В цьому ж напрямку зростає і їх розчинність у воді.
Розглянемо зміну кислотно-основних властивостей водневих сполук в періодах на прикладі сполук ІІ періоду:
В молекулі метану всі валентності насичені атомами Гідрогену. Полярність зв’язку С–Н незначна. Тому метан – це міцна, стійка на повітрі сполука, не взаємодіє ні з кислотами, ні з основами, практично не розчиняється в воді.
В аміаку полярність зв’язку N–Н більша, ніж зв’язку С–Н. Крім того, в Нітрогену є неподілена пара електронів. В зв’язку з цим при розчиненні аміаку в воді утворюється основа: NН3+Н2O Þ NН4++OН–. Отже, вода по відношенню до аміаку виступає в ролі кислоти.
Полярність зв’язку H–F більша, ніж N–Н. При розчиненні цієї речовини в воді утворюється кислота: HF+Н2O Þ Н3O++F–. Вода по відношенню до фтороводню проявляє властивості основ. Здатність молекул води в залежності від умов проявляти властивості кислоти чи основи вказує на її подвійну, амфотерну природу.
Таким чином, в періоді зліва направо посилюються кислотні і послаблюються оснóвні властивості водневих сполук.
Розглянемо зміну кислотно-основних властивостей в групах на прикладах сполук V групи:
Оснóвні властивості водневих сполук V групи послаблюються із збільшенням порядкового номеру елементу. Так, фосфін PН3, на відміну від аміаку, хоча й утворює донорно-акцепторний зв’язок із протоном, що призводить до утворення аналогічних аміаку солей фосфонію з багатьма кислотами, але їх міцність менша, ніж у сполук з іоном NН4+. Ця відмінність фосфіну від аміаку зумовлена значно більшим радіусом атому Фосфору в зрівнянні з атомом Нітрогену. Послаблення оснóвних властивостей рівносильне посиленню кислотних властивостей. В VІІ і VІ групах кислотні властивості водневих сполук p- елементів теж посилюються із збільшенням порядкового номеру елементу.
а) До групи водневих сполук неметалів, що розчиняються у воді без гідролітичного розкладу відносяться сполуки, утворені неметалами, електронегативність яких більша, ніж у Н, наприклад H2F2, HCl, HBr, HI, H2O, H2S, H2Se, H2Te, H3N. Окрім H3N, всі вказані сполуки при взаємодії з H2O віддають Н+, наприклад: HCl + H2O = HCl×Н2О Û Н3О++ Cl–, тоді як H3N відбирає Н+ у НОН: NH3+HOН = NH3×НОН Û NH4++ОН–. Отже, водні розчини таких сполук є або кислотами, або основами. За звичайних умов ці сполуки є газами, окрім H2F2, H2O, H3N, які мають аномально високі температури плавлення та кипіння внаслідок утворення асоційованих молекул за рахунок водневого зв’язку.
Відомі і водневі сполуки, в яких неметали проявляють не максимальний негативний ступінь окиснення: N2Н4 – гідразін, Н2О2 – пероксид гідрогену.
В зв’язку з тим, що в водневих сполуках майже всі неметали проявляють негативну ступінь окиснення, ці сполуки виступають в окисно-відновних реакціях в ролі сильних відновників. Наприклад:
4HCl+MnO2 Þ MnCl2+Cl2+2H2O
4NH3+3O2 Þ 2N2+6H2O
2H2S+SO2 Þ 3S+2H2O
Відновні властивості посилюються в групах із збільшенням порядкового номеру елементу, а в періодах вони слабшають зліва направо.
В якості окисників водневі сполуки неметалів можуть виступати за рахунок наявності в молекулах атому Н в ступені окиснення +1:
2HCl+Zn Þ ZnCl2+H2
2H2O+2Na Þ 2NaOH+H2
Водневі сполуки неметалів можуть вступати і в реакції, які протікають без зміни ступеня окиснення. Наприклад:
CuSO4+5H2O Þ CuSO4·5H2O
HCl+NH3 Þ NH4Cl
K2O+H2O Þ 2KOH
Окремі представники:
HF – рідина (t кип.= 19,9оС) з різким характерним запахом, з водою змішується в любих співвідношеннях (розчин називають плавиковою кислотою)
HCl – безбарвний газ (з.у.) з характерним різким задушливим запахом, добре розчиняється у воді (1:500), утворюючи розчин соляної кислоти (максим.конц.–38%)
HBr – безбарвний газ (з.у.) з різким запахом, добре розчиняється у воді (1:500)
НІ – безбарвний газ (з.у.) з різким запахом, добре розчиняється у воді (1:500)
H2S – безбарвний газ (з.у.) з запахом тухлих яєць, отруйний: сильний відновник, погано розчиняється у воді (1:2,5), розчин називають сірководневою водою
NH3 – безбарвний газ з різким характерним запахом, добре розчиняється в воді (1:700); розчин називають аміачною водою або нашатирним спиртом (максим.конц. 25%); при розчиненні у воді утворюється гідроксид амонію NH4ОН (NH4+ – амоній-іон), який проявляє властивості слабої основи
б) До водневих сполук неметалів, що розкладаються водою, відносять сполуки Бору та Силіцію. Оскільки ці елементи мають менше значення електронегативності, ніж Н, то в своїх водневих сполуках вони проявляють позитивний ступінь окиснення, тоді як Н – негативний (–1).
Відомо багато сполук Бору з Гідрогеном (наприклад, В2Н6, В4Н10, В5Н9, В6Н10, В10Н14, В20Н16), вони дістали загальну назву борани. Наявність Н, який має ступінь окиснення –1 зумовлює той факт, що борани є надзвичайно сильними відновниками. Так, борани:
окислюються киснем повітря (окремі з них самозапалюються);
окислюються галогенами: В2Н6+Cl2 Þ 2ВCl3+6НCl;
розкладаються водою з виділенням Н2: В2Н6+6H2O Þ 2Н3ВО3+6Н2;
В4Н10+12H2O Þ 4Н3ВО3+11Н2;
частково відновлюються лугами: В2Н6+2КОН Þ 2КОВН3+Н2;
В4Н10+4КОН Þ 4КОВН3+Н2;
Борани утворюють продукти приєднання з аміаком: В2Н6+2NH3Þ В2Н6×2NH3
Всі борани одержують тільки непрямим шляхом, головним чином із боридів металів:
4Mg2B+16HCl Þ B4H10+8MgCl2+3H2
Аналогічно сполуки Силіцію з Гідрогеном дістали назву силани. Загальна формула силанів Si n H2 n +2, де n приймає значення від 1 до 6. Хімічні властивості силанів аналогічні боранам. Так, вони можуть самозапалюватися на повітрі; розкладатися водою з виділенням водню і утворенням відповідної кислоти; показовою є реакція галогенування силанів галогеноводнями (а не галогенами, як вуглеводнів): Si2H6+2HBr Þ Si2H4Br2+2H2.
в) До водневих сполук неметалів, що не взаємодіють з водою, відносяться сполуки Н з С (вуглеводні) та Р (фосфіни). Вуглеводнів відомо дуже багато (їх властивості вивчає органічна хімія), тоді як фосфінів – декілька: РН3, Р2Н4, Р12Н6.
Фосфін РН3 – газ, дуже погано розчинний у воді. Утворює нестійкі сполуки приєднання з галогеноводнями. Одержують гідролізом фосфідів металів: Са3Р2+НОН Þ Са(ОН)2+РН3.
Оксиди
Електронегативність всіх неметалів, окрім Флуору, менша, ніж у Оксигену. Це означає, що в сполуках з Оксигеном неметали мають позитивний ступінь окиснення, а Оксиген – негативний; зв'язок між Оксигеном і неметалом – ковалентний полярний. У сполуці з Флуором OF2 Оксиген проявляє позитивну ступінь окиснення і її можна розглядати як фторид оксигену. Сполуки елементу з Оксигеном, ступінь окиснення якого –2, відносять до класу оксидів. Молекули оксидів побудовані так, що в них наявні зв'язки тільки між елементом та Оксигеном. Сполуки елементів з Оксигеном, у молекулах яких між двома атомами Оксигену є зв’язок, називають пероксидами (Н2О2– пероксид гідрогену (Н–О–О–Н).
Назви оксидів складають з двох слів: оксид+назва елементу в родовому відмінку. Відомі оксиди, в яких неметал проявляє властивий йому вищий ступінь окиснення (наприклад, В2О3, СО2, N2O5, SO3, Cl2O7), а також нижчі (наприклад, СО, N2O, NO, N2O3, NO2, СlO2). Якщо елемент утворює декілька оксидів, то після назви елемента вказують його ступінь окиснення (римською цифрою в дужках): оксид сульфуру(ІV) – SO2, оксид сульфуру(VI) – SO3. Окремі оксиди мають і тривіальні назви: СО – чадний газ, СО2 – вуглекислий газ, SiO2 – пісок, N2O – веселящий газ.
За хімічними властивостями оксиди поділяють на солетворні та несолетворні. Несолетворними називають оксиди, які не взаємодіють з водою і не утворюють солей, їх є небагато: СО, SiO, N2O, NO. Оксиди, що під час хімічних реакцій утворюють солі, є солетворними. До них належить більшість оксидів. Оксиди неметалів при взаємодії з водою утворюють відповідні кислоти, тому їх відносять до кислотних оксидів, а також називають ангідридами відповідних кислот.
Властивості оксидів неметалів
Різні кислотні оксиди за звичайних умов мають неоднаковий агрегатний стан. Це можуть бути тверді речовини (В2О3, SiO2, Р2О5,), рідкі (N2О5, SO3, Cl2O7) і газоподібні (всі інші).
Кислотні оксиди проявляють певні загальні (тобто властиві всім) хімічні властивості, а саме:
вступають в реакцію сполучення з водою з утворенням відповідних кислот (в окремих випадках –двох кислот);
вступають в реакцію сполучення з оксидами металів з утворенням солей відповідних кислот;
вступають в реакцію обмінної взаємодії з розчинами лугів з утворенням солі відповідної кислоти і води (сплавлення твердих кислотних оксидів з основами).
Окрім загальних властивостей, окремі оксиди можуть проявляти й інші (властиві тільки даному оксиду) властивості. Так, наприклад, тверді оксиди при сплавленні їх з карбонатами здатні замістити СО2 і утворити відповідні солі; кислотні оксиди, яким відповідають багатоосновні кислоти, можуть взаємодіяти з розчинами середніх солей цієї ж кислоти з утворенням кислих солей; якщо неметал утворює декілька оксидів, то ці оксиди можуть вступати у реакції окислення-відновлення. Нижче наведено приклади рівнянь реакцій оксидів та коротка характеристика оксидів.
| Оксид | Деякі властивості оксиду | Коротка характеристика оксиду |
 2O 2O
| Cl 2O+ H2O Þ 2HClO | Ангідрид хлорнуватистої кислоти. |
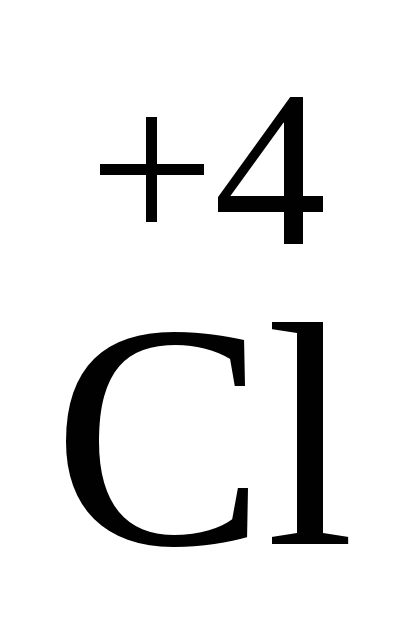 O2 O2
| 2ClO2+ H2O ÞHClO2+HClO3 | Ангідрид хлористої кислоти. Нестійкий. |
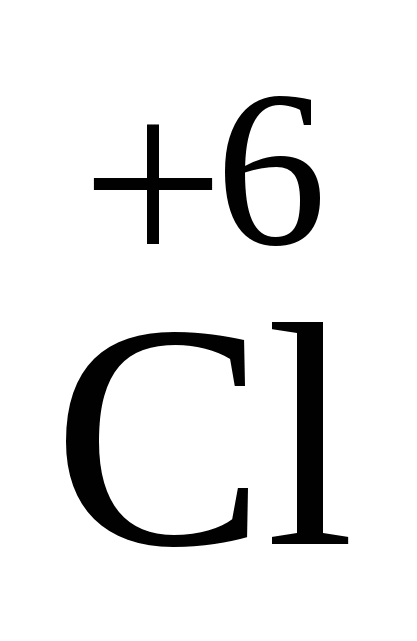 O3 O3
| 2ClO3+ H2O ÞHClO3+HClO4 | Ангідрид хлорнуватої кислоти. Нестійкий |
 2O7 2O7
| Cl 2O7+ H2O Þ 2НClО4 | Ангідрид хлорної кислоти. Безбарвна рідина. |
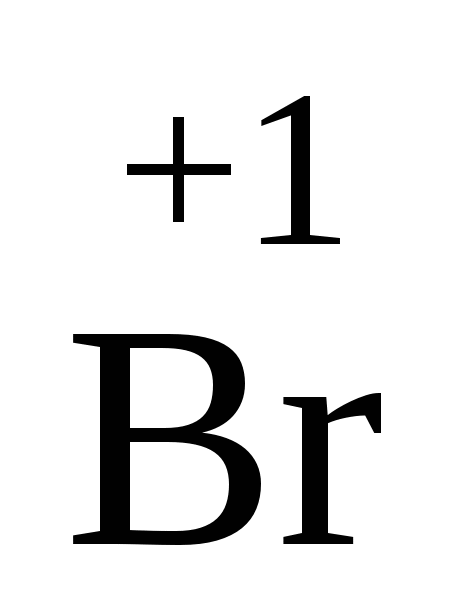 2O 2O
| Br2O+ H2O Þ 2HBrO | |
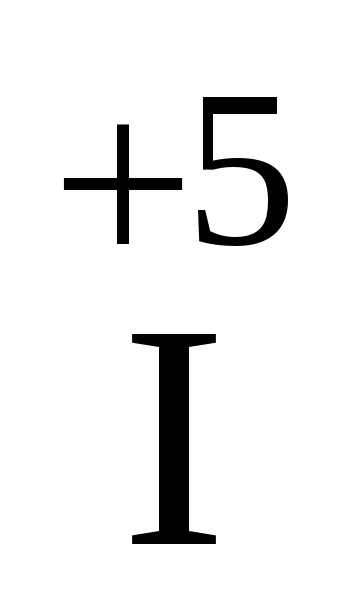 2O5 2O5
| І 2O5+ H2O Þ 2HІO3 | |
 О2 О2
| SО2+ H2O Û Н2SО3 SО2+Na2O Þ Na2SО3 SО2+2NaOH Þ Na2SО3+H2O Проявляє властивості і окисника, і відновника: SO2+O2  SO3; SO2+2H2S+ Þ 3S+2H2O SO3; SO2+2H2S+ Þ 3S+2H2O
| Ангідрид сірчистої кислоти. Безбарвний газ з різким задушливим запахом, розчиняється у воді (1:40) з утворенням |
 О3 О3
| SО3+ H2O Þ Н2SО4 SО3+Na2O Þ Na2SО4 SО3+2NaOH Þ Na2SО4+H2O | Ангідрид сірчаної кислоти. Безбарвна рідина в інтервалі температур 17–45оС, дуже гігроскопічна, добре розчиняється в концентровані сірчаній кислоті, утворюючи так званий олеум |
 2О 2О
| несолетворний оксид; нестійкий: 2N2O Þ 2N2+O2 | Газ без кольору в запаху, погано розчиняється у воді (1:1,3); збуджуюче діє на нервову систему і притупляє больові відчуття, тому використовується як наркотичний засіб |
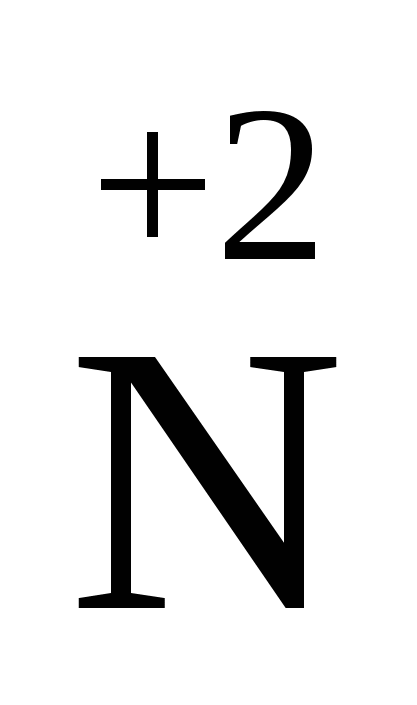 О О
| несолетворний оксид; приєднує О2 (з повітря) та Cl2: 2NO+O2 Þ 2NO2; 2NO+Cl2 Þ 2NOCl NO+NO2  N2O3 N2O3
| Безбарвний газ, слабо розчинний у воді (1:0,08) |
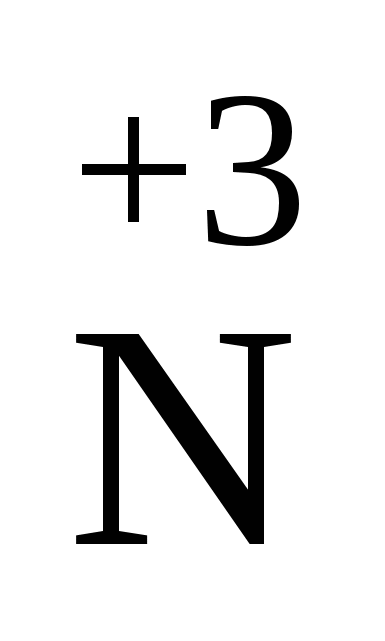 2О3 2О3
| N2О3+ H2O Þ2НNО2 N2О3+ 2NaOH Þ2NaNО2+H2O | Ангідрид азотистої кислоти. Рідина темно-синього кольору, що кипить при 3,5оС |
 О2 О2
| 2NО2+ H2O Þ НNО2+НNО3, а утворена розкладається: 3НNО2ÞНNО3+2NO+Н2О 2NО2+2NaOHÞNaNО2+NaNО3+H2O NO+NO2 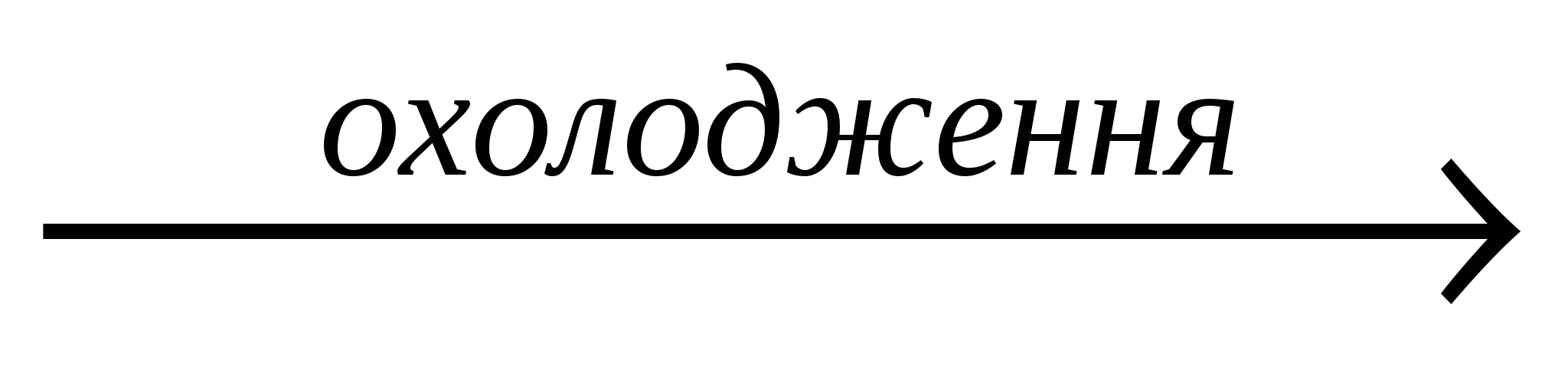 N2O3 N2O3
| Бурий газ з характерним різким запахом, здатний в міру охолодження утворювати димери: 2NО2 ÛN2О4 |
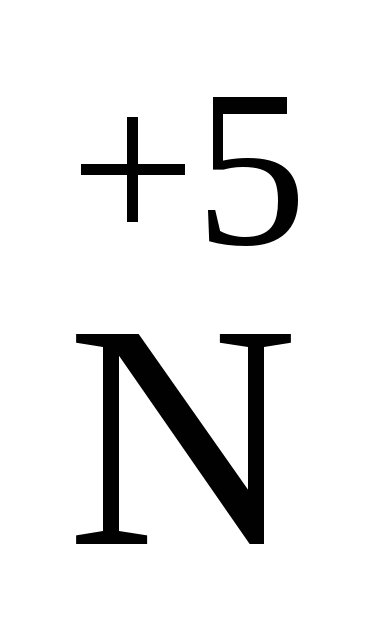 2О5 2О5
| N2О5+ H2O Þ 2НNО3 N2О5+ 2NaOH Þ2NaNО3+H2O 2N2О5  4NO2+O2 4NO2+O2
| Ангідрид азотної кислоти. Тверда кристалічна речовина. |
 2О3 2О3
| Р2О3+ 3H2O Þ2Н3РО3 | Ангідрид фосфористої кислоти. Біла кристалічна речовина, (плавиться при 23,8о)С |
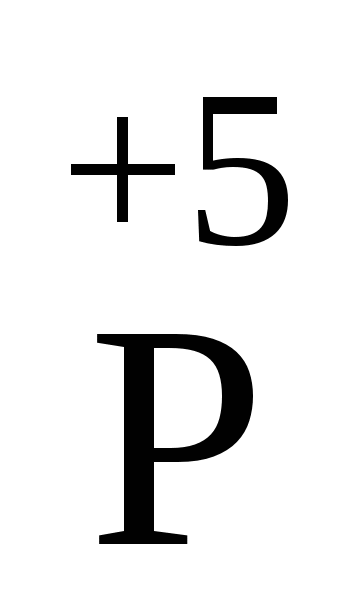 2O5 2O5
| P2O5+3H2O Þ 2H3PO4 P2O5+ H2O Þ 2HPO3 P2O5+CaOÞ Ca(PO3)2 P2O5+3Ca(OH)2ÞCa3(PO4)2+3H2O 2NaHCO3+P2O5  2NaPO3+H2O +CO2 P2O5+4Na3PO4+3H2O Þ 6Na2HPO4 P2O5+Na3PO4+3H2O Þ 3NaH2PO4 P2O5+2Na2HPO4+3H2O Þ 4NaH2PO4 2NaPO3+H2O +CO2 P2O5+4Na3PO4+3H2O Þ 6Na2HPO4 P2O5+Na3PO4+3H2O Þ 3NaH2PO4 P2O5+2Na2HPO4+3H2O Þ 4NaH2PO4
| Ангідрид мета-, орто- та пірофосфорної кислоти. Білий порошок, дуже гігроскопічний, віднімає навіть воду, що входить до складу хімічних сполук. При взаємодії з водою може утворювати три кислоти: |
 О О
| 2СО+О2  2СО2 FeO+CO 2СО2 FeO+CO  Fe+CO2 CO+Cl2 Fe+CO2 CO+Cl2  COCl2 (фосген) CO+2Н2 COCl2 (фосген) CO+2Н2  CH3OH CO+NaOH CH3OH CO+NaOH  HCOONa СO+NH3ÞH2O+HCN (синильна кислота) HCOONa СO+NH3ÞH2O+HCN (синильна кислота)
| Отруйний газ без кольору і запаху (тривіальна назва – чадний газ). Малорозчинний у воді. Несолетворний. Сильний відновник. |
 О2 О2
| СО2+ H2O ÛН2СО3 СО2+Ca(OH)2 Þ CaCO3+H2O CO2+2MgO  2MgO+C CO2+2Mg 2MgO+C CO2+2Mg  2MgO+C CO2+C 2MgO+C CO2+C  2CO CaCO3+H2O+CO2Þ Ca(НCO3)2 процес фотосинтезу: 6 n СО2+6 n Н2О ® (С6Н10О5) n +6Н2О+6О2 2CO CaCO3+H2O+CO2Þ Ca(НCO3)2 процес фотосинтезу: 6 n СО2+6 n Н2О ® (С6Н10О5) n +6Н2О+6О2
| Ангідрид вугільної кислоти. Безбарвний газ (тривіальна назва – вуглекислий газ), малорозчинний у воді, не підтримує дихання і горіння. |
 O2 O2
| SiO2+ H2O ⇏(не взаємодіє) SiO2+ 2NaOH  Na2SiO3+H2O SiO2+ Na2CO3 Na2SiO3+H2O SiO2+ Na2CO3  Na2SiO3+CO2 SiO2+4HF Na2SiO3+CO2 SiO2+4HF  SiF4+2H2O SiF4+2H2O
| Ангідрид кремнієвої кислоти. Тверда кристалічна речовина (пісок), нерозчинна в воді. |
 2О3 2О3
| 3В2О3+2Na3PO4  P2O5+6NaBO2 P2O5+6NaBO2
| Ангідрид борної кислоти. Біла кристалічна або склоподібна речовина |
В періодах кислотні властивості вищих оксидів зростають зліва направо, а в групах – знизу вгору.
Солі амонію(амоніяк) - це кристалічні речовини з іонним типом зв'язку. До складу солей амонію входять один або кілька катіонів і аніон кислотного залишку.
Солі амонію утворюються при взаємодії відповідних кислот з амоніаком або розчином гідроксиду амонію. Більшість солей амонію безбарвні. При взаємодії з сильними основами і нагріванні солі амонію легко розкладаються з утворенням амоніаку. В термічному відношенні солі амонію нестійкі і при нагріванні порівняно легко розкладаються, наприклад:
· NH4Cl = NH3 + HCl
· NH4NO2 = N2 + 2H2O
· NH4NO3 = N2O + 2H2O
· (NH4)2SO4 = 2NH3 + H2SO4
Найважливішими солями амонію є нітрат амонію NH4NO3, сульфат амонію (NH4)2SO4 і хлорид амонію NH4Cl. Вони застосовуються головним чином як азотні добрива. Гідрокарбонат амонію NH4HCO3 (вуглеамонійна сіль, побутова назва амоняк, індекс E 503) використовують як розпушувач тіста.
Для амоніаку характерні реакції приєднання і окислення.
1.Взаємодіє з водою і утворює гідрати NH3.H2O, 2NH3.Н2:
NH3+H2O=NH4OH.
Лужна реакція розчину амоніаку наявністю. Водний розчин NH3 - амоній гідроксид (слабка основа). Фенолфталеїн - малинове забарвлення, розчин NH3 10% нашатирний спирт.
2. Взаємодія з кислотами.Утворюються солі амонію:
NH3+HCl=NH4Cl; 2NH3+H2SO4=(NH4)2SO4
3.Відновні властивості (при нагріванні).
а) згорає у кисні:
4NH3+3О2=2N2+6Н2О;
б)каталітичне окислення:
4NH3+5О2=4NО+6Н2О;
в)реагує з окислювачами:
4H3N +3Br2=6НBr+3N2; 2NH3+3CuO=3Cu+N2+3H2O.
3.Солі амонію.
Солі амонію складаються з катіона амонію та аніана кислоти.
Солі амонію добувають при взаємодії амоніаку або амоній гідроксид з кислотами:
NH3+NHО3=NH4NО3;
2NH3+H2SO4=(NH4)2SO4;
NH4OH+HNO3=NH4NO3+H2O.
У катіоні NH є чотири ковалентні зв'язки:
донор акцептор
Солі амонію виявляють загальні властивості солей:
1) взаємодіють з лугами:
NH4Cl+NaOH=NaCl+NH4OH (NH3 +H2O)
2) взаємодіють з кислотами:
2NH4Cl+H3SO4=(NH4)2SO4+2HCl
3) взаємодіють із солями:
(NH4)2SO4+BaCl2=2NH4Cl+BaSO4
Всі амонійні солі добре розчиняютьсяу воді. У водних розчинах солі добре гідролізують.
NH +H2O=NH4OН+H+
Якісна реакція на NH
1) взаємодія з лугами:
NH +ОН-=NH3 +H2O
Реакцію проводять: у пробірку з сіллю або розчином, що аналізують, вводить розчин лугу і суміш обережно нагрівають. При наявності NH виділяється амоніак.
Добування амоніаку в промисловості.
У промисловості амоніак синтезують з простих речовин Н2 і N2. Реакція азоту з воднем екзотермічна, вона відбувається із виділенням теплоти. Тому для зміщення рівноваги в оборотній системі слід зменшувати температуру. Таке зменшення допускається до 450оС, при нижчій температурі швидкість реакції дуже мала. Рівновага в системі зміщується в бік утворення амоніаку при підвищенні тиску, тому процес проводять при тиску 30Мпа.
Для збільшення швидкості реакції у виробництві амоніаку використовують каталізатори - залізо з добавками алюміній і калій оксидів.
Суміш азоту і водню за допомогою компресора стискується до необхідного тиску. Потім вона очищується, проходячи у контактний апарат, де знаходиться каталізатор. З контактного апарату виходить газова суміш, газів N2 і Н2, що не прореагували. Амоніак легко виділяється з суміші: він зріджується значно легше ніж азот і водень, що не прореагували. Рідкий амоніак добувають у холодильнику і збирають у збірнику.
1 - компресор; 2 - фільтр; 3 - контактний апарат; 4 - холодильник; 5 - збірник.
Застосування.
Значну частину NH3 переробляють на НNO3 і її солі. Амоніак застосують у виробництві соди. Рідкий амоніак, його водний розчин, солі амонію (NH4 NO3, (NH4)2 НРО4, NH4PO4 (NH4)2SO4) використовують як азотні добрива. Рідкий амоніак застосовують як розчинник: у ньому може бути розчинено багато речовин, у тому числі деякі Ме (Na, K). Водневу сполуку азоту N2H4 (гідразин) використовують у хімічних джерелах електричного струму (відновник).
Водний розчин амоніаку (10%) - нашатирний спирт - застосовують у медицині. Отже, якісною реакцією на солі амонію є дія лугів при нагризанні з виділенням аміаку, який виявляють за запахом або посинінням червоного вологого лакмусового папірця.
Хлоридна або соляна кислота — розчин хлороводню (HCl) у воді.
Хлоридна кислота є типовою кислотою. За своєю хімічною активністю вона належить до найсильніших кислот. Подібно до інших сильних кислот вона активно розчиняє більшість металів з виділенням водню, взаємодіє з оксидами металів тощо.
Концентрована хлоридна кислота містить 37% HCl і має густину 1,19 г/см3. Вона має різкий запах і «димить» на повітрі внаслідок виділення газоподібного хлороводню. Технічна кислота має жовтий колір, який обумовлюється домішками головним чином солей заліза.
Хлоридна кислота широко використовується в народному господарстві. Найбільше застосовується вона у хімічній промисловості для добування різних солей: хлориду цинку, хлориду барію та ін., а також для виробництва барвників, лікувальних речовин тощо. Багато хлоридної кислоти споживає також металургійна промисловість для виділення кольорових і рідкісних металів з їх природних сумішей. У хімічних лабораторіях хлоридна кислота належить до найуживаніших реактивів. У невеликих кількостях з неї також одержують водень і хлор.
Треба власт хлор к ти
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 2315; Нарушение авторских прав?; Мы поможем в написании вашей работы!