
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічний зв’язок в органічних сполуках
|
|
|
|
Електронні ефекти
Хімічний зв’язок в молекулах органічних сполук.
Лекція №1
1. Стани атомів в органічних молекулах
2. Хімічний зв’язок в органічних сполуках
3. Взаємний вплив атомів в молекулах органічних сполук
3.1. Індукційний ефект
3.2. Мезомерний ефект
3.3. Ефект надкон’югації
Молекули органічних сполук побудовані за допомогою ковалентних зв’язків, які виникають за рахунок утворення однієї або декількох електронних пар, загальних для взаємодїючих атомів. Такий зв’язок утворюють атоми, які характеризуються рівними або близькими значеннями електронегативностей. Для атомів - органогенів і галогенів ці значення такі:
атом С Н О N S Р С1 Вr
електронегативність 2,5 2,1 3,5 3,0 2,5 2,1 3,0 2,8
Ковалентний зв’язок характеризується енергетичними (енергія зв’язку), геометричними (довжина, валетний кут) та електронними параметрами (полярність, поляризовність та умовний заряд на атомі в молекулі).
Енергіею зв’язку називається енергія, яка поглинається при порушенні або виділяеться при утворенні зв'язку між атомами. Ця енергія є мірою його міцності. Вона визначається з термодинамічних характеристик (теплота утворення з атом1в) або з спектральних даних.
Довжиною зв’язка називається відстань між двома центрами ядер атомів в молекулі, коли сили відштовхування зрівноважені силами притягання й енергія зв’язку мінімальна. Наприклад, довжина зв’язку в молекулі метану дорівнює 0,154 нм, в молекулі води 0,096 нм.
Валентним кутом називається кут між двома осями симетрії електронних орбіталей одного атома при утворенні ними з орбіталями іншого атома ковалентного зв’язку. Наприклад, у молекулах води, амоніаку та метану валентні кути дорівнюють 104°, 106°, 109°28':
Напрямленістю називається законом1рний напрям взаємодії електронних орбіталей у просторі у бік найбільшого перекривання електронної густини при утворенні зв’язку. Напрямленість і валентний кут взаємно пов’язані величини і залежать від природи реагуючих атомів, типу електронних орбіталей, які утворюють зв’язок, розмірів атомів і величин зарядів на них. На рисунках напрямленість іноді показують стрілкою.
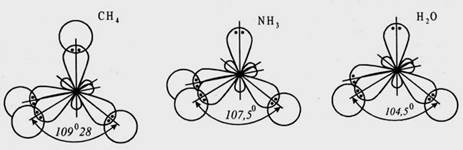
Рис 1. Будова молекул води, амоніаку та метану
Геометричні параметри залежать не тільки від природи атомів, які поєднуються, але й від природи і стану сусідніх атомів. Вони визначаються електронографічними, рентгенографічними та спектральними методами.
Важливою характеристикою ковалентного зв’язку є його насиченість, що зумовлює чотири валентні зв’язки атому Карбону в органічних сполуках.
Електронні параметри зв’язків характеризують розподіл електронної густини у окремих зв'язках і в молекулах у цілому та здатність до зміщення її у просторі під впливом атомів, які утворюють зв’язок або сусідніх атомів. Розподіл електронної густини може змінюватися також під впливом зовнішнього електромагнітного поля (поля сусідніх молекул).
Якщо зв’язок складається з атомів однакових елементів, то спільна електронна хмара розподіляється у просторі симетрично відносно ядер обох атомів. Такий ковалентний зв’язок називається неполярним або гомеополярним. Але у випадку утворення зв’язку атомами різних елементів виникає асиметрія в розподілі заряду і утворюється гетерополярний зв’язок.
Полярністю зв’язку називається наявність електричних зарядів на атомах внаслідок асиметричного розподілу електронної густини між ними.
Поляризацією називається зміщення електронної густини ї ядер атомів в залежності від їх природи під впливом поля сусідніх атомів (цей фактор має велике значення у органічній хімії). Поляризація виникає також під впливом зовнішнього електромагнітного поля (поля сусідніх молекул). Отже полярність виникає внаслідок поляризації.
Полярність зв’язку залежить від довжини його та різниці електро-негативностей атомів, які утворюють зв’язок. Чим більше ця різниця, тим більше полярність. Найбільшу електронегативність мають галогени та Оксиген, тому вони легко перетягують до себе електронну густину зв’язку. В результаті поляризації на атомах утворюється частковий позитивний або негативний заряд, який називається ефективним зарядом (d+, d–).
гідроксильна група карбонільна група карбоксильна група
Рис.2. Розподіл ефективних зарядів у функціональних групах органічних сполук
Ефективні заряди на окремих атомах в молекулах зумовлюють утворення диполів. Диполь – це система, яка складається з двох рівних по величині зарядів протилежного знаку, розташоваиих на певній відстані один від одного. Диполь – це полярні молекули або їх фрагменти. Величина диполю вимірюється за допомогою дипольного моменту (m) – добутку величини заряду на відстань між ними і вимірюється у дебаях (D); 1 D = 10–18 ел.ст.о. × см = 3,33 . 10 –30 Кл × м. Для більшості простих ковалентних зв’язків величина ефективних зарядів не перевищує 0,3 заряду електрону, а дипольний момент зв’язку – 2...4 D.
В загальному випадку необхідно розрізняти поняття полярності молекули у цілому і полярності окремих зв’язків. Дипольний момент молекули є векторна величина, яка дорівнює векторній сумі всіх дипольних моментів окремих зв’язків і неподілених електронних пар в молекулі. Для двохатомних молекул вони збігаються. Наприклад, молекула НС1 і зв’язок Н – С1 полярні, m = 1,08 D; у лінійній молекулі СО2 зв’язок полярний, m = 2,7 D, але в цілому молекула неполярна, тому що векторна сума дипольних моментів зв’язків дорівнює 0. У молекулі Н2О полярні зв’язки (m = 1,56 D)розташовані під кутом 104,5°, тому їх дипольні моменти взаємно не компенсуються і молекула стає  полярною (m = 1,82 D).
полярною (m = 1,82 D).
d+ d–
Н – СІ
Рис 3. Приклади полярних і неполярних молекул НСІ, СО2, Н2О
Іноді замість терміна "полярність" використовується термін "статична поляризація", який підкреслює той факт, що полярність є характеристика молекули, на яку не впливає зовнішнє електромагнітне поле.
Сумарна поляризація молекули має три складові: атомну, електронну та орієнтаційну. Р = Р ат + Р ел + Р ор. Р ат характеризує зміщення атомних ядер у бік негативного кінця диполя, Р ел характеризує зміщення електронів до позитивного полюсу диполя, а Р ор відображає оріентацію в електричному полі молекул, які мають сталий дипольний помент. Р ел складає незначну частину загальної поляризації. Р ор значно зменшується при підвищенні температури.
Поляризацію можна визначити, вимірюючи діелектричну проникність речовини (e)
Р = 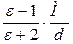 .
.
Поляризовність (a) – це міра здатності до поляризації частини молекули або зв’язку. Іноді поляризовність називають динамічною поляризацією, підкреслюючи, що поляризовність виникає під дією зовнішнього поля й залежить не тільки від будови молекули, але й від величини та напрямку зовнішнього поля сусідніх молекул. Поляризація Р і поляризовність a пов’язані співвідношенням:
Р = 4/3 p N a,
де N – число Авогадро. Розмірність a – см3.
Поляризовність залежить від рухливості електронів. Так, р -електрони більш рухливі, ніж s -електрони, тому p-зв’язок легше поляризується, ніж s-зв’язок.
Реакційна здатність зв’язків в молекулах в більшому ступені залежить від поляризовності, ніж від полярності молекул. Так, у ряді полярних молекул зі зв’язками С – Наl полярність приблизно однакова, але поляризовність у С – І значно вище, тому йодисті алкіли дуже реакційно здатні речовини. У табл. 1 наведені приклади полярності та поляризовності деяких зв’язків. Ці величини можуть значно змінюватися під впливом сусідніх атомів (сусідніх зв’язків). В цьому виявляється взаємний вплив атомів.
s– та p –Зв'язки
Зв’язок між двома атомами, напрямлений вздовж прямої, що сполучає їх ядра та співпадає з віссю симетрії електронних хмар, називається сігма-зв’язком (s – зв’язок).
Таблиця 1.
| Зв’язок | Полярність, В | Поляризовність, см3 |
| С-С | 1,3 | |
| С = С | 4,2 | |
| С º С | 6,2 | |
| С – Н | 0,3 | 1,7 |
| С – О | 0,36 | 1,5 |
| С = О | 2,7 | 3,3 |
| С – С1 | 1,6 | 6,5 |
| С – Вг | 1,5 | 9,6 |
| С – І | 1,6 | 14,6 |
p-Зв’язком називається такий тип зв’язку, при якому максимальне перекривання не проходить через вісь, яка поєднує центри ядер і яке знаходиться над і під площиною s-зв’язків. p-Зв’язок симетричний відносно площини s-зв’язків. Зона перекривання його менше, ніж у s-зв’язка, тому він менш міцний, легше розривається і легко поляризується. p-Зв’язок виникає не тільки між атомами Карбону, але між будь-якими атомами, які мають р -електрони, наприклад, між атомами Карбону та атомами Оксигену, Нітрогену, Сульфуру, тощо. Приклади s- та p-зв’язків наведені на рис. 4.
Рис.4. Приклади s- та p-зв’язків
В молекулах насичених вуглеводнів утворюються s-зв’язки між атомами Карбону і атомами Гідрогену. s-Зв’язок має циліндричну симетрію.
В молекулах ненасичених етиленових та дієнових вуглеводнів є атоми Карбону, які знаходяться у стані sр 2-гібридизації, причому гібридизовані орбіталі утворюють три s-зв’язки, які розташовані у одній площині під кутом 120°. Четвертий р -електрон не гібридизований і утворює з сусіднім атомом Карбону p–зв’язок. Отже, в цих вуглеводнях є подвйний зв’язок, який складасться з s-зв’язку та p-зв’язку.
В ацетиленових вуглеводнях є атоми Карбону, які знаходяться у стані sр -гібридизації, гібридизовані орбіталі утворюють s-зв’язки між атомами Карбону і атомами Гідрогену, які розташовані лінійно (під кутом 180°). Дві р -орбіталі, які не гібридизуються, утворюють два p-зв’язка. Отже, в цих вуглеводнях є потрійний зв’язок, який складається з одного s–зв’язку і двох p–зв’язків.
Спряжені зв’язки
Наявність в молекулі двох або більше подвійних зв’язків, які розташовані через один одинарний (звичайний) спричинює виникненню особливих систем зв’язків, так званих спряжених систем (або кон’югованих систем). Спряження – це взаємодія р – електронів і p-зв’язків сусідніх атомів. Воно виникає, коли у декількох сусідніх атомів карбонового ланцюгу є негібридизована р -електронна хмара, тобто коли є можливістъ взаємодії p-зв’язків або p-зв’язків та р -електронів. Отже, спряжені системи існують у випадках дієнових і ароматичних вуглеводнів. Наприклад, бутадієн-1,3 має такий розподіл електронної густини:
СН2 – СН – СН – СН2
В спряжених системах відбувається делокалізація p-зв’язків вздовж ланцюга, що зменшує загальну енергію системи, вирівнює заряди на атомах і їх треба розглядати як єдину систему зв’язків. Треба підкреслити, що спряження виникає тільки у разі, коли р -електрони знаходяться у одній загальній площині, або близько до неї. Ці зв’язки спричинюють наявності особливих хімічних властивостей сполук.
Особливі спряжені системи існують у ароматичних сполуках. При утворенні циклічної ароматичної системи енергія зменшується, що надає стійкості ароматичним сполукам. В них у циклічному ланцюгу досягається ідеальне спряження всіх р -електронів, розташованих у одній площині і замість просто спряжених зв'язків виникає особливий тип зв’язку – ароматичний зв’язок. Наприклад, у бензені розподіл електронної густини такий:
Рис.5. Розподіл електронної густини в молекулі бензену
Взагалі взаємодія p-зв’язку і р -електронів виникає й у випадках, коли між собою пов’язані атоми різної природи. Але в таких системах відбувається не делокалізація р -електронів, а чергування позитивних і негативних зарядів вздовж ланлюга, тобто виникає альтернуючий перерозподіл густини. Такі системи інакше називають мезомерними. Мезомерні системи утворюються в таких випадках:
1.Подвійний зв’язок і неподілена р -електронна пара через один s-зв’язок:
. СН2 = СН – С1 (вінілхлорид);
 2. Ароматична система і подвійний зв’язок через одинарний зв’язок:
2. Ароматична система і подвійний зв’язок через одинарний зв’язок:
– С = О
Н (бензойний альдегід);

 3.Ароматична система та неподілена р -електронна пара через одинарний зв’язок:
3.Ароматична система та неподілена р -електронна пара через одинарний зв’язок:
NН2 (анілін) ОН (фенол).
Для порівняння довжини та міцності зв’язків у карбонових ланцюгах деякі приклади з них наведені у таблиці 2
Таблиця 2. Значения енергй зв’язків та їх довжини
Зв’язок Енергія, кДж/моль Довжина, нм
С–С (алкани) 350 0,154
С = С(алкени) 610 0,135
С ºС (алкіни) 836 0,120
С – С (діени) 0,148
С– С (арени) 0,140
Міжмолекулярні взаємодії
Міжмолекулярною взаємодією називається взаємодія між молекулами, що не супроводжується додатковим усуспільненням електронної густини, тобто утворенням нових зв’язків. Молекулярна взаємодія визначає різницю між реальними та ідеальними газами, існування рідин і молекулярних кристалів. Поняття про міжмолекулярну взаємодію вперше було введено голландським вченим І. Д. Ван-дер-Ваальсом, тому сили міжмолекулярної взаємодії часто називають ван-дер-ваальсовими.
Дипольні моменти молекул звичайно мають порядок 4,8 D. Якщо полярну молекулу помістити в електричне поле, відбувається деформація електронних хмар і відстань між центрами маси позитивних і негативних зарядів збільшується, тобто відбувається поляризація молекули. У результаті поляризації в молекулі виникає додатковий дипольний момент, який називається індукованим чи наведеним – mінд.
m = mст + mінд,
де mст – сталий дипольний момент молекули. Величина індукованого диполь-ного моменту пропорційна напруженості поля Н (якщо вона не занадто велика):
mінд = Н . a,
де a – поляризовність молекул, яка характеризує здатність електронних хмар деформуватися під впливом електричного поля. Поляризовність атомів збільшується зі зростанням атомного номера та розмірів атома, зі збільшенням числа електронів; d- електронні хмари перехідних металів деформуються легше, ніж s - і р -хмари.
Види міжмолекулярної взаємодії
Основу міжмолекулярної взаємодії складають кулоновські сили, що виникають між електронами та ядрами молекул. Взаємодія залежить від відстані між молекулами r, їхньої взаємної орієнтації, будови та електричних властивостей (дипольного моменту, поляризовності та ін.). При досить високих r, які значно переважають розміри молекул, можна виділити три типи взаємодії.
Диполь-дипольна (ориєнтаційна) взаємодія
При зближенні двох полярних молекул вони орієнтуються так, щоб енергія системи була мінімальною. Цій умові відповідає орієнтація, при якій позитивний кінець однієї молекули сусідить з негативним кінцем іншої молекули. У газах і рідинах орієнтації полярних молекул перешкоджає тепловий рух. Енергія орієнтаційної взаємодії між двома однаковими диполями дорівнює
Е ор = –  ,
,
де m – дипольний момент молекули; r – відстань між центрами диполів; k – стала Больцмана. Важливо відзначити, що ця енергія обернено пропорційна шостого ступеня r і абсолютній температурі.
Взаємодія диполь – індукований диполь (індукційна взаємодія)
Присутність полярної молекули поблизу інший, котра може бути полярною чи неполярною, поляризує цю молекулу й викликає появу в ній індукованого дипольного моменту. Індукований дипольний момент має той же напрямок, що і постійний. Взаємодія постійного диполя однієї молекули з наведеним диполем другої знижує енергію системи на величину, яка називається енергією індукційної взаємодії Е инд. При взаємодії полярної і неполярної молекул
Е инд = –  .
.
Таким чином, енергія індукційної взаємодії, так само, як і орієнтаційної, зменшується пропорційно шостого ступеня відстані, але не залежить від температури, тому що орієнтація наведеного диполя визначається тільки напрямком постійного диполя. Прикладами речовин, у яких має місце індукційна взаємодія, можуть служити гідрати інертних газів. Сильно полярні молекули води индукують диполі в неполярних молекулах цих речовин, що веде до утворення слабких зв'язків.
Дисперсійна взаємодія (ефект Лондона)
Цей вид взаємодії має місце між неполярними молекулами. У чистому виді дисперсійна взаємодія виявляється в інертних газах і рідких неполярних речовинах (бензені, толуолі, ін.). У неполярних молекулах розподіл електронної густини симетрично і дипольний момент відсутний, електронні хмари постійно коливаються коло ядер, утворюючи тимчасові чи миттєві диполі. Обидві молекули будуть мати дипольні моменти, спрямовані в одну сторону, і притягатися друг до друга. У наступний момент диполі в молекулах можуть бути спрямовані в протилежну сторону. Дипольні моменти виникають лише на мить, але сумарний ефект їхньої взаємодії — це постійно діючі сили притягання. У результаті дисперсійної взаємодії енергія системи знижується на величину
Е дисп = – 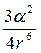 h n0,
h n0,
де h n0 – енергія коливання атомів при 0 °С з частотою n0. Величина Е дисп залежить від поляризовності молекул.
Особливістю дисперсійної взаємодії є її загальність, тому що у всіх полярних і неполярних молекулах є електрони, що рухаються. Надзвичайно низькі температури конденсації й твердіння інертних газів (для неону, наприклад, температура плавлення дорівнює –249 °С, а температура кипіння –246 °С) свідчать про слабкість цих сил. У цілому сили Ван-дер-ваальса в 100...300 разів слабкіше сил, що зв’язують атоми в молекули.
Усі три види енергії взаємодії негативні, що означає зниження енергії системи в міру зближення молекул, тобто вказує на сили притягання між молекулами. З трьох названих найбільш сильним є диполь-дипольна взаємодія. Речовини, молекули яких полярні, звичайно мають більш високі температури плавлення, чим речовини, що складаються з неполярних молекул.
На дуже близьких відстанях між молекулами виникають сили відштовхування в результаті перекривання замкнутих (заповнених) електронних оболонок.
Водневий зв’язок
Крім універсальної Ван-дер-ваальсової взаємодії між молекулами може виникати водневий зв’язок. Водневий зв’язок є специфічною міжмолекулярною взаємодією, тому що можливість його виникнення і міцність залежать від хімічної природи речовини.
Водневий зв’язок – це зв’язок між позитивно поляризованим атомом водню однієї молекули і атомом електронегативного елементу (Оксигену, Нітрогену, Хлору, Флуору, рідко – Сульфуру) другої молекули.
Виникнення водневого зв’язку обумовлено двома причинами:
1. Атом водню, зв’язаний полярним ковалентним зв’язком з другим атомом, фактично не має електронів і здатний легко впроваджуватися в електронні хмари інших атомів;
2. Атом водню має вакантну s -орбіталь і може приймати неподілену електронну пару другого атома, утворюючи з ним донорно-акцепторний зв’язок.
У загальному вигляді процес утворення водневого зв’язку має такий вигляд:
Х – Н + Y «X – H …Y.
Тут Х i Y – атоми електронегативних елементів.
Енергія водневого зв’язку не дуже велика – 8...40 кДж, що набагато більше енергії міжмолекулярної взаємодії та приблизно в 10 разів менше енергії ковалентних зв’язків. Так, енергія зв’язку Н…О дорівнює 21 кДж, Н…F – 42 кДж, Н…N – 8,4 кДж.
Незважаючи на невелику міцність водневого зв’язку, він іноді визначає структуру речовини і має великий вплив на її фізичні та хімічні властивості. Найбільш типовий приклад сполуки з водневими зв’язками — це вода. У рідкому стані вода знаходиться у виді асоціатів (Н2О) n. Мірою енергії міжмолекулярної взаємодії можуть служити температура кипіння та теплота випарування D Н вип рідини. Порівняно високі значення Т кип і D Н исп води – наслідок асоціації в результаті виникнення водневих зв’язків. Насамперед, вода має аномально високу температуру кипіння. Відомо, що температури кипіння рідин підвищуються зі збільшенням молярної маси. Температура кипіння сірководню, у якому водневі зв’язки виражені слабко, дорівнює –60,8 °С. Якби у воді були відсутні водневі зв’язки, вона кипіла б при більш низькій температурі й на Землі не було би водойм – уся вода знаходилася б у газоподібному стані. Завдяки ажурній структурі льоду він має меншу густину, ніж рідка вода. Тому лід плаває на поверхні води, узимку водойми не промерзають до дна, що зберігає живі істоти. Утворенням тетраедричної структури пояснюється унікальна властивість води – розширюватися при замерзанні. При плавленні льоду при атмосферному тиску структура зберігається, з цим зв’язані біологічні властивості «поталої» води.
Завдяки цього зв’язка молекули багатьох других сполук з’єднуються в димери й більш складні асоціати, які є стійкими сполуками. Асоціати можут бути одномірними (ланцюговими, або циклічними), двомірними (сітки) та трьохмірними. Прикладом одномірних асоціатів можуть бути зігзагоподібні та циклічні полімери з молекул флуороводню, димери ацетатної й мурашиної кислот:

 НС =О ... НО
НС =О ... НО
ОН ... О = СН димер мурашиної кислоти.
Асоціація призводить до підвищення температур плавлення, кипіння, теплоти пароутворення, в’язкості, зменшення леткості. Часто розчинення речовин теж пов’язують з утворенням водневого зв’язку. Так змішення води і спирту супроводжується виділенням теплоти і зменшенням об’єму, що вказує на присутність хімічних взаємодій між цими речовинами.
Завдяки водневим зв’язкам молекули протеїнів зберігають свою спіральну форму, вони ж утримують разом подвійні спіралі ДНК, обумовлюють певну конфігурацію ланцюгів природних і штучних полімерів.
Водневий зв’язок часто впливає і на хімічні властивості речовин. Наприклад, у ряді флуороводнева кислота – хлорводнева кислота, перша з них – слабка, а друга – сильна, що пояснюється утворенням димерів та інших асоціатів, не здатних дисоціювати з розривом зв’язку Н…F.

 Поряд з міжмолекулярними водневими зв’язками при сприятливих умовах водневий зв’язок може здійснюватися між різними частинами однієї молекули. У цьому випадку його називають внутрішньомолекулярним. Прикладом таких молекул можуть служити молекули орто-хлорфенолу і саліцилового альдегіду:
Поряд з міжмолекулярними водневими зв’язками при сприятливих умовах водневий зв’язок може здійснюватися між різними частинами однієї молекули. У цьому випадку його називають внутрішньомолекулярним. Прикладом таких молекул можуть служити молекули орто-хлорфенолу і саліцилового альдегіду:
О СН
Сl ... Н О–Н ... О
Розрив ковалентних зв’язків може йти двома шляхами. При гомолітичному (радикальному) розриві загальна електронна пара роз’єднується і утворюються радикали. Радикалом називається нейтральна частина, яка має неспарений електрон. Схема радикального розриву така:
Х:У® X  +
+  У
У
Радикальному розриву піддаються малополярні або неполярні зв’язки (С – С, С – Н, N – N, S – S) при високій температурі, під дією сонячного світла або радіоактивного випромінювання.
Гетеролітичний розрив зв’язків призводить до утворення заряджених частинок – карбокатіонів і карбаніонів:
X: У ® Х :– + У+.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 10914; Нарушение авторских прав?; Мы поможем в написании вашей работы!