
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
В атомі не може бути навіть двох електронів з однаковими значеннями чотирьох квантових чисел
|
|
|
|
Електрони, що перебувають на різних орбіталях, відрізняються хоча б одним з трьох квантових чисел n, l та m, набір яких характеризує певну електронну орбіталь. Якщо ж вони перебувають на одній орбіталі, то відмінність може спостерігатись тільки стосовно квантового числа ms. Але ms набуває лише двох значень. Тому можна зробити висновок: на одній орбіталі (в енергетичній комірці) може знаходитися не більше двох електронів, які характеризуються протилежними значеннями ms. Перебування в комірці третього електрона означало б, що у двох електронів усі чотири квантових числа рівні між собою, а це суперечить принципу Паулі.
Використовуючи принцип Паулі, можна розрахувати максимальне число електронів на енергетичних рівнях та підрівнях. Число орбіталей на підрівні дорівнює 2l + 1, а число електронів 2(2l + 1). Підставивши l = 0, 1, 2, 3, знаходимо, що число електронів на цих підрівнях становить 2, 6, 10 та 14.
Загалом число електронів на енергетичному рівні знаходимо за формулою 2n2, де n – головне квантове число.
Складання електронних формул та електронно-графічних схем атомів елементів
Стан електронів у атомах характеризується:
1) Запасом енергії електрона – відстань від ядра атома, на якій найбільш ймовірне перебування електрона. Позначається цифрами 1, 2, 3, 4, 5, 6, 7. Електрони з однаковим запасом енергії утворюють енергетичні рівні.
2) Певною формою електронної хмари – обіталлю. За формою орбіталі ділять на s, p, d, f. s-Орбіталь має форму сфери, p-орбіталь – форму гантелі, d-орбіталь – форму двох гантелей, що перетинаються в одній площині під прямим кутом, f-орбіталь – трьох гантелей, що перетинаються під прямим кутом у трьох взаємно перпендикулярних площинах.
3) Наявністю електронів з різними орбіталями на одному і тому ж енергетичному рівні – утворення підрівнів.
4) Напрямком руху навколо власної осі – спіном. На одній орбіта лі може бути лише два електрони, що мають антипаралельні(протилежно направлені) спіни.
Стан електронів у атомі можна зображати за допомогою електронних формул і схем. Наприклад:
Н – 1s1,
де Н – символ атома елемента Гідрогену, 1 – перший енергетичний рівень, s - форма орбіталі електрона, s1 – кількість електронів на підрівні. Тобто, цей запис означає, що на першому енергетичному рівні у атома Гідрогену рухається один електрон, хмарка якого має сферичну форму.
Це ж можна записати у вигляді графічної схеми, в якій стрілочка ↑, записана в клітинці, означає електрон.
Заповнюються енергетичні рівні поступово, із зростанням зарядів атомних ядер. Будову електронних оболонок можна передати так:
| Енергетичні рівні (n) | Кількість орбіталей рівня | Форма орбіталей | Максимальна кількість електронів (N) |
| S | 2 (s2) | ||
| s, p | 8 (s2 p6) | ||
| s, p, d | 18 (s2 p6 d10) | ||
| 4-7 | s, p, d, f | 32 (s2 p6 d10 f14) |
Найбільше число електронів, що можуть перебувати на енергетичному рівні, визначається за формулою N = 2n2, тобто рівне подвоєному квадрату номера рівня.
Заповнення орбіталей здійснюється за принципами:
1) Правило Клечковського (принцип найменшої енергії) – за ним спочатку заповнюються ті орбіталі, на яких перебувають електрони з меншим запасом енергії. Виглядає цей порядок так:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s →
4f → 5d → 6p → 7s → 5f → 6d → 7p
2) Принцип Паулі – на кожній орбіталі може одночасно перебувати не більше двох електронів з антипаралельними спінами:
↑↓
3) Правило Хунда – спочатку заповнюється половина кожної орбіталі, і лише коли вичерпані всі вільні „комірки”, в кожну добудовується ще один електрон з антипаралельним спіном.
Якщо скласти всі показники (кількість електронів кожного підрівня) на всіх енергетичних рівнях, то одержимо загальну кількість електронів, що рівна порядковому номеру елемента.
Складання формул сполук за валентністю
Валентністю (точніше ковалентністю) називають здатність атома елемента утворювати хімічні зв’язки з певною кількістю атомів інших елементів. Одиницею валентності є валентність атома Гідрогену, який у сполуках одновалентний (тобто утворює зв’язки з атомом іншого елемента шляхом утворення пари електронів чи віддачі одного електрона). Знаючи валентність елементів, можна складати формули сполук. Для цього треба виконати такі кроки:
1) Написати символи хімічних елементів, при чому символ менш електронегативного пишеться ліворуч:
Cl O
2) Над символами записати римським цифрами валентності елементів у даній сполуці:
VII II
Cl O
3) Знайти найменше спільне кратне чисел, що позначають валентності:
VII (14) II
Cl O
4) Найменше спільне кратне по черзі ділимо на валентність кожного елемента, щоб знайти індекси:
14: 7 = 2 (індекс біля хлора), 14: 2 = 7 (індекс біля оксигену).
5) Отримані індекси записуємо біля відповідних символів і одержуємо формулу хлор (VII) оксиду:
Cl2O7.
Для формул небінарних сполук валентність катіона та аніона можна взяти у таблиці розчинності. Наприклад, запис S2- означає, що сульфід двохвалентний, запис  означає, що амоній одновалентний. Тому формула амоній сульфіду буде відповідно (NH4)2S.
означає, що амоній одновалентний. Тому формула амоній сульфіду буде відповідно (NH4)2S.
Визначення валентності за хімічною формулою
Знаючи валентність одного з елементів у бінарній сполуці, легко встановити валентність іншого (якщо, наприклад, він має змінну валентність). Для цього потрібно зробити наступні кроки:
1) Записати формулу:
Fe2O3
2) Над елементом з відомою валентністю проставляємо її римською цифрою:
ІІ
Fe2O3
3) Знаходимо сумарну валентність всіх атомів у даному випадку Оксигену в даній сполуці:
2 х 3 = 6
(всіх атомів Оксигену в даній молекулі три, кожен з них двохвалентний, тому сумарна валентність шість).
4) Визначаємо валентність елемента, у якого вона змінна (в даній сполуці це Ферум), для цього сумарну валентність ділимо на індекс Феруму
6: 2 = 3,
(міркуємо так: шість одиниць валентності розподілити між двома атомами Ферему, тож на кожен припадає по три, тому Ферум у сполуці тривалентний).
В небінарних сполуках валентність йона з змінною валентністю визначаємо за допомогою валентності йона, валентність якого відома:
ІІ
Fe2(SO4)3
Оскільки валентність сульфат-йона два, а в сполуці їх є три, то шість одиниць сумарної валентності припадає на два атоми Феруму, тому по три на кожен. Значить, валентність Феруму – три.
Встановлення залежності властивостей елементів
від періодичної зміни будови атомів.
Фізичний зміст періодичної системи.
1. Порядковий номер елемента рівний заряду ядра та загальній кількості електронів.
2. Номер періода рівний числу електронних рівнів та номеру зовнішнього електронного рівня.
3. Номер групи: а) для головних підгруп рівний максимальній валентності та кількості електронів на зовнішньому енергетичному рівні, б) для побічних підгруп – максимальній валентності.
Періодичні закономірності в структурі атомів.
В періодах зліва направо:
- збільшується кількість протонів (зростає заряд ядра) і тому посилюється притягання електронів;
- зменшується радіус атомів, оскільки електрони потрапляють на одну і ту саму оболонку, яка стиск5ається внаслідок посилення притягання до ядра;
- зростає електронегативність – здатність атома притягувати до себе електрони;
- зовнішня конфігурація змінюється від s1 (лужний метал) до s2p6 (інертний газ).
Таким чином, на початку періоду розміщуються елементи з переважанням металічних властивостей, атоми яких легко віддають електрони, перетворюючись у позитивно заряджені йони. В кінці періоду (перед інертним газом) розміщуються елементи з переважанням неметалічних властивостей, атоми яких легко приймають електрони, перетворюючись в негативно заряджені йони.
Періодична зміна властивостей пояснюється певною повторюваністю у заповненні зовнішніх електронних шарів.
В групах зверху донизу:
- збільшується число електронних рівнів;
- збільшуються радіуси атомів;
- послаблюється притягання електронів до ядра;
- послаблюється здатність приєднувати електрони;
- посилюються металічні властивості.
Отже, металічні властивості зростають зверху донизу і справа наліво, а неметалічні властивості – навпаки – зростають зліва направо і знизу доверху.
Періодичні зміни властивостей елементів.
І. Переходи від металів до неметалів.
| властивості | метали | неметали |
| фізичні | Провідники, еластичні (ковкі) | Ізолятори, крихкі |
| хімічні | Утворюють основні оксиди, виступають відновниками, утворюють катіони, втрачаючи електрони | Утворюють кислотні оксиди, виступають окисниками, утворюють аніони, приєднуючи електрони |
ІІ. Відмінності між s-, p-, d-елементами.
| блоки елементів | властивості | ||
| фізичні | хімічні | ||
| s-елементи | М’які прості речовини, безбарвні сполуки, низька температура плавлення | Луги у водних розчинах, сильні відновники, валентність у сполуках рівна номеру групи | |
| d-елементи | Тверді прості речовини, забарвлені сполуки, висока температура плавлення | У воді неактивні, валентність змінна, здатність до утворення комплексних йонів, катіони у водних розчинах гідролізовані | |
| p-еле-менти | метали | Прості речовини м’які і з меншою температурою плавлення, ніж у d-елементів | Мають дві валентності, виключення – Алюміній |
| неметали | Тверді, рідкі або газоподібні прості речовини | Змінна валентність |
ІІІ. Зміна властивостей вниз по групах.
Подібні властивості всередині груп елементів визначаються електронами зовнішньої оболонки. Тенденції зміни властивостей елементів і відмінності, які з’являються при русі вниз по групі, пов’язані зі зміною числа внутрішніх електронів і, отже, зі зміною розмірів атомів. Атоми елементів у верхній частині груп часто такі малі, що ці елементи мають незвичні, відмінні від решти елементів групи, властивості. Збільшення числа внутрішніх оболонок є причиною спостережуваних змін. Однакові зовнішні оболонки обумовлюють схожість властивостей.
IV. Вздовж періодів.
| властивості | початок періоду | кінець періоду |
| фізичні | метал провідник ковкий | неметал ізолятор крихкий |
| хімічні | основи у водному розчині відновники катіони | кислоти у водному розчині окисники аніони |
Складання характеристики хімічних елементів
за положенням у періодичній системі
та будовою атома
План характеристики
І. Назва елемента, його символ, відносна атомна маса.
ІІ. Положення в періодичній системі:
1) порядковий номер елемента;
2) номер періоду;
3) номер групи, підгрупа (головна чи побічна).
ІІІ. Будова атома.
1) заряд ядра;
2) кількість протонів, нейтронів, електронів;
3) електронна формула, електронно-графічна схема зовнішнього енергетичного рівня;
4) кількість електронних рівнів;
5) кількість електронів на зовнішньому енергетичному рівні, число електронів, яких не вистачає до завершення енергетичного рівня.
IV. Металічні чи неметалічні властивості переважають:
Властивості простої речовини:
| Для металів взаємодія з: | Для неметалів взаємодія з: |
| а) киснем; б) неметалами; в) кислотами. | а) киснем; б) металами; в) воднем. |
V.Вищий оксид:
1) Формула, місце в класифікації (основний, кислотний, амфотерний);
2)Властивості:
| Для основних | Для амфотерних | Для кислотних |
| Взаємодія з: а) водою; б)кислотними оксидами; в) кислотами. | Взаємодія з: а)кислотами; б) основами. | Взаємодія з: а) водою; б) основними оксидами; в) лугами. |
VІ. Вищий гідроксид:
1) Формула, місце у класифікації (характер);
2) Властивості:
| Для основ | Для амфотерних гідроксидів | Для кислот |
| Взаємодія з: а)кислотами; б) кислотними оксидами; в) солями. | Взаємодія з: а) кислотами; б) лугами; в) термічний розклад (розкладання за високої температури). | Взаємодія з: а) основами; б) основними оксидами; в) солями; г) металами. |
VІІ. Воднева сполука:
| Для металів | Для неметалів |
| а) Метали головних підгруп утворюють гідриди, нелеткі сполуки; б) Метали побічних підгруп не утворюють водневих сполук. | а)Неметали ІІІ, IV груп утворюють леткі сполуки; б) Неметали V групи утворюють леткі сполуки в) Неметали VІ, VІІ груп утворюють леткі сполуки – кислоти. |
Визначення типу хімічного зв’язку
Хімічний зв’язок – це взаємодія двох або кількох атомів, у результаті якої утворюється хімічно стійка двох- або багатоатомна система (молекула чи кристал. Енергія утвореної система менша за енергію складових частин (атомів).
Механізм утворення хімічного зв'язку: відбувається перекривання електронних хмар, підвищення електронної густини між ядрами атомів, що сприяє притяганню позитивно заряджених ядер. При цьому виконується правило октету – при утворенні хімічного зв'язку атоми прагнуть до створення стійкого восьми електронного шару інертного газу. Виключення – елементи першого періоду (Гідроген та Гелій), які мають не октет, а дуплет (два) електронів на енергетичному рівні, оскільки це максимальна кількість електронів на першому енергетичному рівні.
Способи утворення октету:
1) Атоми віддають електрони зовнішнього енергетичного рівня, при цьому оголюється октет електронів попереднього рівня, а атоми перетворюються в позитивно заряджені йони:
Ме0 – ne- → Меn+,
Мg0 – 2e- → Мg2+.
Такий спосіб характерний для металів і неметалів.
2) Атоми приєднують електрони, яких не вистачає до октету, при чому самі перетворюються в негативно заряджені йони:
Е0 + ne- → Еn-,
Cl0 + 1e- → Cl-,
O0 + 2e- → O2-.
Такий спосіб характерний для неметалів.
3) Атоми усуспільнюють неспарені електрони зовнішнього енергетичного рівня, утворюючи спільні (подільні) електронні пари. Характерно для неметалів.
Cl∙ + ∙Cl → Cl:Cl (Cl2).
Утворення спільних електронних пар пояснюється перекриванням електронних хмар. Є два способи перекривання електронних хмар:
а) утворення σ – зв’язків, коли електронні хмари перекриваються вздовж лінії, яка з’єднує центри обох атомів. Це відбувається за умови, що перекриваються дві s-орбіталі, s- і p-орбіталь або дві p-орбіталі;
б) утворення π – зв'язків, коли р-електорнні хмари перекриваються над і під площиною, в якій проходить лінія, що з’єднує центри атомів.
Типи хімічних зв'язків.
1. Ковалентний зв’язок – це зв’язок, що виникає між атомами елементів з однаковою або близькою за величиною електронегативністю (як правило, між атомами неметалів). Для нього характерний обмінний механізм (в утворенні електронної пари від кожного атома бере участь по одному електрону).
Ковалентний зв’язок можна розділити на неполярний та полярний. Неполярний виникає між атомами з однаковою електронегативністю:
О: +:О → О:=:О (О2).
Полярний виникає між атомами з різною електронегативністю:
Н∙+ ∙Cl → Н:Cl (НCl).
Донорно-акцепторний зв’язок – це різновид ковалентного зв'язку, що виникає між атомами елементів, один з яких має власну електронну пару, а другий – вільну орбіталь на зовнішньому енергетичному рівні. Класичний приклад – утворення йона амонію. У Нітрогена, сполученого з трьома атомами Гідрогену, є надлишок негативного заряду (він виникає внаслідок більшої електронегативності Нітрогену) і власна неподільна електронна пара 2s2 – електронів, а йон Гідрогену має великий дефіцит негативного заряду і вільну орбіталь після втрати електрона. Тому між ними виникає зв’язок за донорно-акцепторним механізмом, внаслідок чого утворюється позитивно заряджений йон амонію (NH4)+.
2. Йонний зв’язок – це зв’язок між різнойменно зарядженими йонами. Йони – це заряджені частинки, на які перетворюються атоми в результаті втрати чи приєднання електронів:
Мg0 – 2e- → Мg2+, Cl0 + 1e- → Cl-.
Тоді за рахунок електростатичного притягання між ними виникає зв’язок:
Мg2+ + 2 Cl- → MgCl2.
Металічний зв’язок виникає між атомами металів, у яких число електронів на зовнішньому енергетичному рівні незначне в порівнянні із загальним числом зовнішніх орбіталей. Електрони переходять з однієї орбіталі на іншу і утримують усі атоми разом. Ці усуспільнені електрони називають електронним газом і вони визначають фізичні властивості металів (ковкість, непрозорість, електро- та теплопровідність тощо).
Водневі зв’язки виникають між атомами Гідрогену однієї молекули та електронегативними елементами (наприклад, Оксигеном, Нітрогеном, Флуором) іншої. Ці зв’язки визначають фізичні властивості (температура кипіння, в’язкість, розчинність у воді, поверхневий натяг краплі тощо) значної кількості неорганічних та органічних сполук. Класичний приклад – вода, а також кислоти, спирти тощо.
Загалом, щоб визначити тип хімічного зв'язку, варто пам’ятати такі моменти:
- між атомами в простих речовинах, утворених неметалами, виникає ковалентний неполярний зв’язок;
- між атомами в складних речовинах, утворених елементами-неметалами, виникає ковалентний полярний зв’язок;
- між йонами типових металів та неметалів виникає йонний зв’язок;
- між атомами та йонами металів виникає металічний зв’язок.
Класи неорганічних сполук
Оксиди – це складні речовини, до складу яких входять атоми двох елементи, один із яких – Оксиген.
Загальна формула оксидів:
n II
Е2Оn
Назви оксидів походять від назв елементів з додаванням слова оксид. У випадку змінної валентності елемента вона вказується римськими цифрами в дужках після назви елемента.
Оксиди ділять на три основні групи: основні (утворені типовими металами); кислотні (утворені типовими неметалами та металами у найвищих ступенях окиснення); амфотерні (утворені перехідними металами у середніх та нижчих ступенях окиснення та Алюмінієм).
Кислотні оксиди ділять також на солетворні і несолетворні, а основні – на розчинні і нерозчинні у воді.
Кислоти – це складні речовини, до складу яких входить один або кілька атомів Гідрогену і атом або група атомів кислотного залишку.
Загальна формула кислот:
І n
Нn (кислотний залишок)
Кислоти класифікуються за вмістом Оксигену – на оксигеновмісні та безоксигенові, за основністю (кількістю атомів Гідрогену) – на одно-, дво- та триосновні.
Основи – це складні речовини, до складу яких входить атом металу і одна або кілька гідроксильних груп.
Загальна формула основ:
m I
Ме(ОН)m
Назви основ походять від назви металу з додаванням слова гідроксид. У випадку змінної валентності металу вона вказується в дужках після назви металу.
Виділяють розчинні у воді основи – луги (це гідроксиди лужних та лужноземельних металів) і нерозчинні у воді – гідроксиди важких металів. Виділяють також групу амфотерних гідроксидів, яким відповідають певні амфотерні оксиди.
Солі – це складні речовини, до складу яких входить один або кілька атомів металу і один чи кілька кислотних залишків.
Загальна формула солей:
m n
Меn (кислотний залишок)m
Назви солей походять від назви металу та назви кислотного залишку. У випадку змінної валентності металу її вказують римськими цифрами в дужках після назви металу.
Солі ділять на кілька груп.
Середні солі – продукти повного заміщення атомів Гідрогену у кислоті на атоми металу.
Кислі солі – продукти неповного заміщення атомів Гідрогену у кислоті на атоми металу.
Осно́вні солі – продукти неповного замішення гідроксогруп у основі на кислотний залишок (утворюються при неповній нейтралізації основи кислотою).
Подвійні солі –продукти заміщення атомів Гідрогену в кислоті двома різними металами.
Мішані солі – ті, що утворені атомом одного металу і кількома різними кислотними залишками.
Комплексні солі – ті, що утворені складними комплексними йонами.
Класифікація хімічних реакцій
Є ряд ознак, за якими класифікують хімічні реакції. Серед них виділимо наступні:
1. За зміною числа реагуючих речовин та продуктів реакції
а) Реакції сполучення, під час яких з двох або кількох речовин утворюється одна.
б) Реакції розкладу, під час яких з однієї речовини утворюється декілька простих чи складних речовин.
в) Реакції заміщення, під час яких атоми простої речовини заміщують частину атомів у молекулі або кристалі складної речовини.
г) Реакції обміну, під час яких молекули складних речовин обмінюються складовими частинами. Частковий випадок цього типу реакцій – реакції нейтралізації, коли кислота нейтралізується лугом.
2. За зміною ступеня окиснення елементів, що входять до складу реагуючих речовин
а)Реакції без зміни ступеня окислення атомів у складі реагуючих речовин.
б)Окисно-відновні реакції.
3. За тепловим ефектом
а) Екзотермічні – ті, що супроводжуються виділенням енергії.
б) Ендотермічні – ті, що супроводжуються поглинанням енергії.
4. За напрямом реакції
а) Оборотні – ті, що за певних умов відбуваються одночасно в протилежних напрямках.
б) Необоротні – ті, що відбуваються в одному напрямку. Реакції йонного обміну проходять до кінця, якщо утворюються осад, газ, малодисоційована сполука (наприклад, вода).
5. За участю каталізатора
а) Каталітичні – ті, що проходять за участі каталізатора.
б) Некаталітичні – ті, що проходять без участі каталізатора.
6. За агрегатним станом середовища
а) Гомогенні – коли реагуючі речовини перебувають в одній фазі (рідкій, твердій, газоподібній).
б) Гетерогенні – коли реагуючі речовини перебувають в різних фазах.
Енергетика хімічних реакцій
Екзотермічними називають ті реакції, при проходженні яких теплота виділяється, а ентальпія зменшується:
2Н2 + О2 = 2Н2О + Q
ΔН <0, Q >0.
Ендотермічними називають хімічні реакції, під час яких теплота поглинається, а ентальпія зростає:
СаСО3 = СаО + СО2 - Q
ΔН >0, Q <0.
Значення теплових ефектів реакцій (або зміни еннтальпій) часто відносять до 1 моль речовини і однакових умов (стандартні умови: температура 25°С, тиск 101,3 кПа). Термохімічні рівняння – це хімічні рівняння, в яких вказано тепловий ефект реакції:
Н2(г.)+  О2(г.) = Н2О (р.) ΔН = -286 кДж/моль
О2(г.) = Н2О (р.) ΔН = -286 кДж/моль
2Н2 + О2 = 2Н2О ΔН = -572 кДж/моль
Теплота утворення – кількість теплоти, яка виділяється або поглинається при утворенні 1 моль сполуки з простих речовин.
Теплота згоряння – кількість теплоти, яка виділяється або поглинається при згорянні 1 моль речовини.
Швидкість хімічної реакції
Швидкість реакції визначається кількістю речовини, що прореагувала в одиниці об’єму за одиницю часу ( ).
).
Швидкість реакції залежить від природи реагуючих речовин і, як правило, зростає за умови:
а) підвищення температури;
б) підвищення концентрації реагентів;
в) для гетерогенних реакцій – із зростанням площі поверхні стикання реагентів.
Vгомог. = 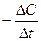 ,
,
Vгетерог. = 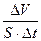 .
.
Закон дії мас: швидкість хімічної реакції за сталої температури прямо пропорційна добутку концентрації реагуючих речовин (крім твердої фази).
2А + В = С,
V = K ∙c2 (A) ∙ c(B),
або V = K ∙ [A]2 ∙[B].
Правило Вант-Гоффа: з підвищенням температури на кожні 10° швидкість більшості з хімічних реакцій зростає в 2-4 рази (в рівнянні γ – температурний коефіцієнт реакції).
V 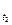 = V
= V 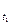 ∙γ
∙γ 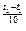 .
.
Хімічна рівновага в оборотних процесах
Хімічна рівновага – це такий стан системи, коли швидкість прямої реакції рівна швидкості оборотної Vпр. = Vзв..
3H2 + N2 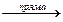 2NH3,
2NH3,
3H2 + N2  2NH3,
2NH3,
Константа хімічної рівноваги не залежить від концентрації реагуючих речовин, а залежить лише від температури. Наприклад, для реакції
3H2 + N2 = 2NH3,
ця константа визначається так:
К = 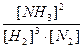 .
.
Вплив зовнішніх умов на хімічну рівновагу
Принцип Ле Шательє: Якщо на врівноважену систему діяти ззовні (температура, тиск, концентрація), то рівновага зміщується в напрямку тієї реакції, яка протидіє цій зміні.
Наприклад, для реакції
3H2 + N2 = 2NH3 +Q
а) Підвищення тиску прискорить пряму реакцію, бо до реакції сумарний об’єм вихідних газоподібних речовин складає 4, а після реакції – лише 2. Зниження тиску навпаки прискорить зворотню реакцію.
б) Підвищення температури прискорить зворотню реакцію, бо вона ендотермічна, і сповільнить пряму, бо вона екзотермічна.
в) Підвищення концентрації вихідних речовин прискорить пряму реакцію, а підвищення концентрації продуктів реакції – зворотню.
г) Каталізатор прискорює обидві реакції, тому на хімічну рівновагу не впливає.
Теорія електролітичної дисоціації
Особливості водних розчинів електролітів пояснив шведський вчений С.Арреніус. Для цього він створив теорію електролітичної дисоціації (1887 рік). Пізніше вона була розширена і доповнена рядом вчених. На даному етапі розвитку основні положення теорії виглядають так:
1) У розчинах і розплавах електроліти розпадаються на заряджені частинки – йони. Процес розпаду електролітів на йони називають електролітичною дисоціацією.
2) Для сполук з ковалентними зв’язками електролітична дисоціація – процес оборотний, для йонних сполук в ненасичених розчинах – необоротний. Асоціація – об’єднання протилежно заряджених йонів.
3) Йони в розчинах рухаються хаотично, а під дією електричного струму – спрямовано. Позитивно заряджені йони притягуються до катода і називаються катіонами. Негативно заряджені йони притягуються до анода і називаються аніонами.
4) Ступінь дисоціації залежить від природи електроліту та розчинника, від температури і концентрації. Ступінь дисоціації – це відношення числа молекул, що розпалися на йони, до загального числа молекул розчиненої речовини. Виражається в частках одиниці аба у відсотках. За ним електроліти ділять на сильні (ά → 1) і слабкі (ά → 0).
5) В розчинах утворюються нестійкі хімічні сполуки розчиненої речовини і розчинника – сольвати. У випадку, коли розчинником виступає вода, їх називають гідратами.
З точки зору ТЕД кислоти – це електроліти, що дисоціюють з утворенням катіона гідрогену та аніона кислотного залишку, основи – електроліти, що дисоціюють з утворенням катіона металу і аніона гідроксогрупи, солі – електроліти, що дисоціюють з утворенням катіона металу і аніона кислотного залишку.
Реакції йонного обміну – це реакції, що відбуваються в розчинах електролітів за участю йонів без зміни ступеня окиснення елементів. Такі реакції проходять до кінця, якщо:
а) випадає осад;
б) виділяється газ;
в) утворюється малодисоційована сполука (наприклад, вода).
Окисно-відновні реакції
Ступінь окиснення елемента – це умовний заряд його атома у молекулі чи кристалі, якщо припустити, що вони складаються тільки з елементарних катіонів та аніонів, наприклад (Н1+)2О2. Ступінь окиснення називають ще окиснювальним числом і позначають цифрою з відповідним знаком над символом хімічного алемента: Os+8, Re+7, Cr+6, Au+5, S+4, Cl+3, N+2, O-2, I-1, C0, Si-4.
У молекулярних сполуках типу H2O, NO, С2H5OH, Н2S, NH3 йони відсутні, проте можна з повним правом говорити про ступені окиснення елементів у цих та подібних сполуках. Ступінь окиснення елемента з більшою електронегативністю позначають числом із знаком мінус, тоді другий елемент з меншою електронегативністю матиме додатній ступінь окиснення. Так, Флуор – найактивніший неметал, його електронегативність найвища. Завдяки особливостям своєї електронної структури він у всіх сполуках має лише один ступінь окиснення, а саме -1. Оксиген має ступінь окиснення переважно -2 (у пероксисполуках -1), тільки в сполуках з Флуором +2. Лужні метали проявляють ступінь окиснення +1, лужноземельні +2, алюміній +3 тощо.
Виходячи з того, що молекули і кристали звичайних сполук електронейтральні, можна визначити знак і величину ступеня окиснення різних елементів. Для цього треба скласти просте алгебраїчне рівняння. При цьому треба враховувати, що сумарний заряд усіх атомів у молекулі чи кристалі дорівнює нулю.
Окисно-відновні реакції – це реакціїі, що відбуваються із зміною ступенів окиснення елементів.
Правила визначення ступеня окиснення в сполуках
| №п/п | Правила | Приклади |
| 1. | Ступінь окиснення атомів у простих речовинах рівний нулю. | N02, О02, F02, Al0, Fe0, C0, S08, P04 |
| 2. | Ступінь окиснення простого йона рівний його заряду | Al+3, Fe+2, Cl-, S-2 |
| 3. | Гідроген у нейонних сполуках з неметалами має ступінь окиснення +1, а в йонних (гідридах металів) – 1. Виключення – гідриди металів і проста речовина. | Н+12О, СН+14, СаН-12, Н02. |
| 4. | Ступінь окиснення Оксигену – 2. Виключення фторид оксигену, пероксидні сполуки та проста речовина. | NО-2, Н2О -2; O+2F2, Н+2О-2, О02 |
| 5. | Алгебраїчна сума ступенів окиснення атомів у складному йоні рівний його заряду | (N+5O-23)- (N-3H+4)+ |
| 6. | Алгебраїчна сума ступенів окиснення атомів у складній речовині рівна нулю | К2S+4O3 + (+2) + (+4) + (-2×3) = 0 |
Правила складання окисно-відновних рівнянь методом електронного балансу
1. Запишіть схему рівняння реакції:
P4 + Ba(OH)2 + H2O = Ba(H2PO2)2 + PH3↑.
2. Визначте ступені окиснення атомів всіх елементів і позначте їх вгорі справа над символами елементів:
P04 + Ba+2(O-2H+1)-12 + H+12O-2 = Ba+2(H+12P+1O-22)-12 + P-3H+3.
3. Визначити елементи, атоми яких змінили ступені окиснення:
P04 + Ba+2(O-2H+1)-12 + H+12O-2 = Ba+2(H+12 P+1 O-22)-12 + P-3 H+3.
4. За різницею ступенів окиснення окисника та відновника до і після реакції визначити, скільки електронів втратив відновник і скільки електронів приєднав окисник:
P0 -1е ® P+1 – відновник,
P0 + 3е ® + P-3 – окисник.
5. Для цих чисел знаходимо найменше спільне кратне:
P0 -1е ® P+1 │1е │
│ │ 3
P0 + 3е ® + P-3 │3е │
6. Найменше спільне кратне поділіть на число електронів, що втратив відновник, потім на число електронів, що приєднав окисник. Знайдені числа – це коефіцієнти для окисника та відновника.
P0 -1е ® P+1 │1е │ │3
│ │ 3│
P0 + 3е ® + P-3 │3е │ │1
7. Знайдені коефіцієнти проставте перед окисником та відновником відповідно до і після реакції:
3P4 + Ba(OH)2 + H2O = 3Ba(H2PO2)2 + PH3↑.
8. Решту коефіцієнтів розставте методом підбору:
2P04 + 3Ba(OH)2 + H2O = 3Ba(H2P+1O2)2 + 2P-3H3↑.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1748; Нарушение авторских прав?; Мы поможем в написании вашей работы!