
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Склад, будова та функції білків
|
|
|
|
Із органічних речовин, що входять в склад живих організмів, найбільш важливими в біологічному відношенні і найбільш складними за хімічною структурою є білки. Одне з визначень поняття «життя» так і звучить: життя – це форма існування білкових тіл.
Термін „білки” виник вперше в зв'язку із знаходженням в тканинах тварин і рослин речовин, що подібні за деякими властивостями до яєчного білка (при нагріванні вони розкладаються). Ці речовини Мульдер в 1838 р. назвав протеїнами (з грец. proteous - перший), тобто вони являються важливими складовими живої матерії, без якої неможливе життя. Нині поняття „білки” - збірне для цілого класу речовин.
При вивченні хімічної структури білків було встановлено, що основною їх структурною одиницею – мономером – являються амінокислоти. Таким чином білки – це високомолекулярні, органічні, N – вмісні біополімери, які складаються в основному з амінокислот. Загальна формула амінокислот має вигляд:
 |  |
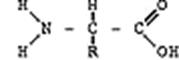
аміногрупа карбоксильна група
 |
радикал
Наявність аміногрупи та карбоксильної групи є спільною ознакою для всіх амінокислот. Аміногрупа зумовлює основні властивості амінокислоти, карбоксильна – кислотні. Таким чином в цілому молекула амінокислоти проявляє амфотерні хімічні властивості. Радикал – у кожної амінокислоти різний і визначає індивідуальні властивості молекули.
 |
При аналізі складу білків представників різних царств живої природи виявилось, що усі вони складаються з комбінацій 20 видів амінокислот. До сьогодні усі вони добре вивчені:
 |
Амінокислотні ланцюжки завдовжки від двох до кількох десятків амінокислотних залишків зазвичай називають пептидами, при більшому ступені полімеризації — власне білками або протеїнами, хоча цей поділ вельми умовний. Поліпептидний ланцюг утворюється шляхом взаємодії молекул амінокислот:

 |
Пептидний зв’язок
Виділяють чотири рівні структури білків:
· Первинна структура —послідовність амінокислотних залишків у пептидному ланцюжку. Саме первинна структура найбільшою мірою визначає властивості сформованого білка і є індивідуальною для кожного організму.
· Вторинна структура — впорядковування фрагменту поліпептидного ланцюжка, стабілізоване водневими зв'язками і гідрофобними взаємодіями. Найпоширеніший тип вторинної структури білків – спіраль
· Третинна структура — повна просторова будова цілої білкової молекули, стабілізована водневими зв’язками, дисульфідними містками тощо. Білки що складаються з одного поліпептидного ланцюга, мають тільки третинну структуру.
· Проте деякі білки побудовані з кількох ланцюгів. Для них уведено поняття четвертинної структури, що описує взаємне розташування поліпептидних ланцюгів один відносно одного.
Як правило, білки протягом досить довгого часу зберігають структуру і, отже, фізико-хімічні властивості, наприклад, розчинність, в умовах, до яких пристосований даний організм або які підтримуються в його межах в результаті збереження гомеостазу. Різка зміна цих умов, наприклад, внаслідок нагрівання або обробки білка кислотою чи лугом, приводить до втрати четвертинної, третинної і вторинної структур білка, цей процес називається денатурацією. Процес денатурації є оборотним: за умови що первинна структура молекули залишилась неушкодженою, можливе відновлення вторинної, третинної, четвертинної структур. Процес відновлення називається ренатурацією. Процес руйнування усіх структур білка, включаючи первинну має назву деструкція.
| Функції білка | Приклади |
| Будівельна | Утворюють основу цитоплазми та входять до складу усіх органел клітини. |
| Каталітична | Більшість ферментів, які каталізують хімічні реакції мають білкову природу. |
| Рухова | Будь який рух у живій природі здійснюється білковими структурами клітин. |
| Транспортна | Білок гемоглобін транспортує кисень та вуглекислий газ. Альбумін – вищі жирні кислоти тощо. |
| Захисна | Білкову природу мають чинники імунітету антитіла. Білок входить до складу шкіри, волосяного покриву ссавців. |
| Регуляторна | Ряд гормонів за своєю будовою належить до білків (інсулін, глюкагон). |
| Запасна | Білки здатні накопичуватись як запасна речовина переважно у рослин. У тварин - овоальбумін (яйцеклітини) та казеїн (молоко). |
| Опорна | Сухожилля, суглоби, кістки скелета у своєму складі містять білки. |
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 4482; Нарушение авторских прав?; Мы поможем в написании вашей работы!