
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Модуль 1. Основи медичної хімії 6 страница
|
|
|
|
A. Nа +
B. CO3 2-
C. К+
D. Са2+
E. SО42-
614. Який з іонів буде адсорбуватися на адсорбенті (осаді) барію сульфату?
A. Nа +
B. CO3 2-
C. Сl -
D. *Bа2+
E. РО43-
615. Який з іонів буде адсорбуватися на адсорбенті (осаді) аргентуму сульфіду?
A. Nа +
B. *S 2-
C. Сl -
D. Са2+
E. SО42-
616. Який з іонів буде адсорбуватися на адсорбенті (осаді) кальцію карбонату?
A. Nа +
B. S 2-
C. Сl -
D. *Са2+
E. SО42-
617. Який з іонів буде адсорбуватися на осаді CaCO3?
A. Nа +
B. *CO3 2-
C. Сl -
D. Bа2+
E. SО42-
618. Який з іонів буде адсорбуватися на осаді CaCO3?
A. Nа +
B. S 2-
C. Сl -
D. *Са2+
E. SО42-
619. Який з іонів буде адсорбуватися на осаді аргентуму хлориду?
A. Nа +
B. *Ag+
C. Ba2+
D. Са2+
E. SО42-
620. Які іони адсорбуються на осаді AgCl?
A. *Сl-
B. Mg2+
C. Nа +
D. Са2+
E. SО42-
621. Які іони адсорбуються на адсорбенті (осаді) AgCl?
A. Nа+
B. S2-
C. *Сl-
D. K+
E. SО42-
622. Який з іонів буде адсорбуватися на осаді аргентуму хлориду?
A. Nа +
B. S 2-
C. *Сl-
D. Са2+
E. SО42-
623. Який з іонів буде адсорбуватися на осаді аргентуму хлориду, що є адсорбентом?
A. Fе2+
B. Сu2+
C. *Аg +
D. Са2+
E. К+
624. Яке з тверджень правильне:
A. ПіАР тільки збільшують поверхневий натяг
B. ПіАР зменшують поверхневий натяг у 5 разів
C. ПіАР зменшують поверхневий натяг у 2 рази
D. ПіАР не змінюють поверхневий натяг
E. *ПіАР збільшують або не змінюють поверхневий натяг
625. Збільшення концентрації одного або декількох компонентів у поверхневому шарі адсорбента називають:
A. *Адсорбція.
B. Гемосорбція.
C. Десорбція.
D. Сорбція.
E. Абсорбція.
626. Яким методом вимірюють поверхневий натяг
A. Кріометрії
B. Метод Тромера
C. *Сталагмометричний метод
D. Комплексонометрії
E. Потенціометричний метод
627. Правило Дюкло-Траубе стверджує, що поверхнева активність ПАР у водних розчинах однакової концентраці:
A. зменшується у 3-3,5 рази із збільшенням довжини ланцюга на одну -СН2 - групу
B. зменшується у 1-1,5 рази із зменшенням довжини ланцюга на одну -СН2 - групу
C. не змінюється із зменшенням довжини ланцюга на одну -СН2 - групу
D. *збільшується у 3-3,5 рази із збільшенням довжини ланцюга на одну -СН2 - групу
E. збільшується у 3-3,5 рази із зменшенням довжини ланцюга на одну -СН2 - групу
629. Зміну концентрації деякого компонента у поверхневому шарі адсорбента називають:
A. Капілярна конденсація
B. Гемосорбція
C. Cорбція.
D. *Адсорбція.
E. Абсорбція.
630. До методів вимірювання поверхневого натягу належить:
A. Кріометрія
B. Метод Тромера
C. *Сталагмометричний метод
D. Комплексонометрія
E. Потенціометричний метод
631. Якщо ∆σ/∆с › 0, то згідно з рівнянням Гібса адсорбція є:
A. Стане безмежною
B. Додатною
C. *Негативною
D. Позитивною
E. Дорівнювати нулю
632. Яке з тверджень правильне:
A. ПАР збільшують поверхневий натяг у 3 рази
B. *ПАР зменшують поверхневий натяг
C. ПАР збільшують поверхневий натяг у 4 рази
D. ПАР не змінюють поверхневий натяг
E. ПАР збільшують поверхневий натяг у 2 рази
633. Поверхневий натяг рідини залежить від:
A. Температури замерзання розчину
B. *Природи речовини
C. Здатності речовини до дифузії
D. Обєму рідини в посудині
E. Зовнішнього тиску на розчин
634. Поверхневий натяг вимірюється в таких одиницях:
A. Н/см2
B. Дж/см
C. *Дж/м2
D. Н/м2
E. Дж/м3
635. Одиниця вимірювання поверхневого натягу - це:
A. Н/м2
B. Дж/м
C. Дж/м
D. *Н/м
E. Дж/м3
636. Яка з речовин є поверхнево-активною (ПАР)?
A. Хлорид калію
B. *Спирт ізопропіловий
C. Хлорид натрію
D. Гідроксид кальцію
E. Кислота хлоридна
637. До поверхнево-інактивних речовин не належить:
A. Хлорид калію
B. *Спирт ізопропіловий
C. Хлорид натрію
D. Гідроксид кальцію
E. Кислота хлоридна
638. Що таке адсорбція?
A. Видалення молекул, які розміщуються в поверхневому шарі
B. Збільшення об’єму речовини
C. Утворення осаду
D. Поглинання речовини всім об’ємом іншої речовини
E. *Зміна концентрації компонентів у поверхневому шарі порівняно з об’ємом фази
639. Енергія, якою володіють молекули, розташовані на межі розділу фаз, називається
A. *Поверхневою енергією
B. Енергією активації
C. Енергією Гемгольца
D. Внутрішнью енергією
E. Ентальпією
640. Якщо адсорбція позитивна, то відношення ∆σ/∆с згідно з рівнянням Гіббса є:
A. *Від’ємне
B. Додатне
C. Дорівнює безмежності
D. Позитивне
E. Дорівнює нулю
641. До поверхнево- активних речовин належать всі речовини, крім:
A. Ефір діетиловий
B. Білок
C. Сіль жирної кислоти
D. *Кислота хлоридна
E. Спирт пропіловий
642. Математичний вираз для розрахунку поверхневого натягу такий:
A. σ = C/RT
B. σ = νRT
C. σ = S/G
D. σ = GS
E. *σ = G/S
643. Процеси, які відбуваються на межі поділу фаз, називаються:
A. Кипінням
B. Абсорбцією
C. Внутрішньомолекулярними
D. *Поверхневими явищами
E. Коагуляцією
644. З якого інертного металу виготовляється окисно-відновний електрод?
A. Кальцію
B. Заліза
C. Натрію
D. *Платини
E. Калію
645. У якій сполуці ферум перебуває у відновленій формі
A. Fe2 (S04)3
B. FeCl3
C. *FeSO4
D. Fe (OH)3
E. Fe2O3
646. У якій сполуці ферум перебуває в окисненій формі
A. FeCl2
B. *FeCl3
C. FeSO4
D. Fe(OH)2
E. FeO
647. Яке значення ступеня окиснення мангану у перманганаті калію KMnO4
A. +2
B. *+7
C. +6
D. +5
E. +4
648. Яке значення ступеня окиснення нітрогену у нітриті калію КNО2
A. +1
B. +2
C. *+3
D. +5
E. +7
649. Хлорсрібний електрод виготовляється з такого металу...
A. Кальцію
B. Заліза
C. Натрію
D. *Срібла
E. Калію
650. Потенціометрія - це:
A. Вимірювання густини розчинів
B. Зниження темп. замерзання розчинів
C. Підвищення темп. кипіння розчинів
D. Злиття частинок дисперсної фази при втраті агрегатної стійкості
E. *Фізичний метод дослідження з вимірюванням електрорушійної сили
651. Прилад, в якому відбувається перетворення хімічної енергії в електричну, називається:
A. Термометром
B. Фотометром
C. *Гальванічним елементом
D. Вольтметром
E. Калориметром
652. Роботі хлорсрібного електроду відповідає рівняння:
A. AgCl + e = Ag + Cl-
B. Ox + Ze = Red
C. Hg2Cl2 + 2e = 2Hg + 2Cl-
D. MA + Ze = M + A z-
E. AgCl = Ag+ + Cl-
653. Схематичний запис цинкового електрода першого роду:
A. Hg/Hg2Cl2, KCl
B. Ag/AgCl, KCl
C. *Zn/Zn2+
D. Zn/ZnSO4, SO42-
E. Pt, H2/2H+
654. Водневому електроду відповідає рівняння:
A. *2H+ + 2e = H2
B. Ox + Ze = Red
C. Hg2Cl2 + 2e = 2Hg + 2Cl-
D. MA + Ze = M + A z-
E. Мz+ +Ze = M
655. Схематичний запис хлорного електрода:
A. *Pt, Cl2/2Cl-
B. Ag/AgCl, KCl
C. Zn/Zn2+
D. Ме/Меn+
E. Pt, H2/2H+
656. Стандартний електродний потенціал, Е0 вимірюється при умовах:
A. Концентрація. іонів металу 1моль/л при 00С
B. Концентрація іонів металу 1моль/л при 200С
C. Концентрація іонів металу 0,1моль/л при 200С
D. Концентрація іонів металу 0,1моль/л при 250С
E. *Концентрація іонів металу 1моль/л при 250С
657. Газовим електродом є електрод
A. Hg/Hg2Cl2, KCl
B. Ag/AgCl, KCl
C. Zn/Zn2+
D. Ag/Ag+
E. *Pt, H2/2H+
658. Схематичний запис водневого електрода
A. Hg/Hg2Cl2, KCl
B. Ag/AgCl, HCl
C. Zn, H2/2H+
D. Fe, H2/2H+
E. *Pt, H2/2H+
659. Потенціал хлорсрібного електрода залежить від концентрації
A. Фосфат-іонів
B. Сульфат-іонів
C. Нітрат-іонів
D. Сульфат-іонів
E. *Хлорид-іонів
660. Схематичний запис каломельного електрода
A. *Hg/Hg2Cl2, KCl
B. Ag/AgCl, KCl
C. Zn/Zn2+
D. Ме/Меn+
E. Pt, H2/2H+
661. Схематичний запис хлорсрібного електрода:
A. Hg/Hg2Cl2, KCl
B. *Ag/AgCl, KCl
C. Zn/Zn2+
D. Ме/Меn+
E. Pt, H2/2H+
662. У склад водневого електрода входить:
A. Срібна пластина, занурена в розчин нітрату срібла
B. Платинова пластина, занурена в розчин власних іонів
C. Платинова пластина, занурена в розчин сульфату цинку
D. Платинова пластина, занурена в розчин хлориду натрію
E. *Платинова пластина, занурена в розчин сірчаної кислоти
663. До електродів 2-го роду належить електрод
A. Водневий
B. Залізний
C. Мідний
D. Срібний
E. *Хлорсрібний
664. Що означає е0 у рівнянні Нернста 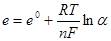
A. Ізохорно-ізотермічний потенціал
B. Ізобарно-ізотермічний потенціал
C. Хімічний потенціал
D. Електрорушійну силу
E. *Стандартний електродний потенціал
665. Що означає a у рівнянні Нернста 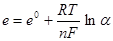
A. Електродний потенціал
B. Число електронів
C. Об”єм розчину
D. *Активність іонів
E. Валентність
666. Що означає n у рівнянні Нернста
459. 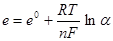
A. Число еквівалентів
B. *Число електронів
C. Кількість речовини
D. Ступінь окиснення металу
E. Валентність
667. Електрорушійна сила вимірюється у.таких одиницях.....
A. Ватах
B. Метрах
C. *Вольтах
D. Джоулях
E. Амперах
668. При якій температурі вимірюється стандартний електродний потенціал?
A. 278 К.
B. *298 К
C. 293 К
D. 273 К
E. 300 К
669. Одиниця вимірювання електродного потенціалу - це.
A. Ват
B. Метр
C. Джоуль
D. *Вольт
E. Ампер
670. Одиниця вимірювання електродного потенціалу - це.
A. Вт
B. М
C. Дж
D. *В
E. А
671. Система, в якій хімічна енергія окисно-відновного процесу перетворюється в електричну, називається.
A. Хімічним елементом
B. Поляриметром
C. *Гальванічним елементом
D. Термостатом
E. Кріоскопом
672. Величину електродного потенціалу розраховують за рівнянням:
A. Бойля - Маріотта
B. *Нернста
C. Менделєєва - Клайперона
D. Арреніуса
E. Вант-Гоффа
673. До електродів першого роду належить електрод:
A. Cu / Cu(ОН)2
B. Ag / AgCl
C. Hg, Hg2CI2 / KCI;
D. *Ag / AgNO3
E. Ag, AgCI / KCI
674. У стандартному водневому електроді газоподібний водень знаходиться під тиском:
A. 1,013 кПа
B. 1013 Па
C. *101,3 кПа
D. 101,3 Па
E. 10,13 кПа
675. Величина електродного потенціалу не залежить від:
A. Кількості іонів металу
B. *Об’єму розчину
C. Температури розчину
D. Активності іонів металу
E. Стандартного електродного потенціалу
676. Електрорушійну силу, що виникає між двома електродами, вимірюють за допомогою:
A. Ареометра.
B. Манометра.
C. *Потенціометра
D. Міліамперметра
E. Полярографа
677. При зануренні мідної пластини у розчин CuSO4 переважає процес осадження катіонів металу на пластині. Якого заряду набуває пластинка?
A. - 100 В
B. - 10 В
C. *Позитивного
D. Рівного нулю
E. Негативного
678. Електродний потенціал якого електрода умовно дорівнює нулю?
A. Хлорсрібного.
B. Скляного
C. *Водневого
D. Платинового
E. Цинкового
679. Якщо робота гальванічного елемента є процесом термодинамічно оборотним, то робота хімічної реакції визначається зміною:
A. Потенціальної енергії.
B. Внутрішньої енергії
C. *Ізобарно-ізотермічного потенціалу
D. Ентропії
E. Ентальпії
680. Величина стандартного електродного потенціалу залежить тільки від:
A. Тиску
B. Об’єму розчину
C. *Природи електрода
D. Температури
E. Концентрації іонів
681. Величина електродного потенціалу дорівнює стандартному електродному потенціалу при активності іонів металу, що дорівнює:
A. 100 моль/л.
B. 0,01 моль/л.
C. 10 моль/л;
D. 0,1 моль/л;
E. *1 моль/л;
682. Електрорушійна сила, що виникає між двома електродами, дорівнює:
A. Відношенню двох електродних потенціалів
B. Інтегралу двох електродних потенціалів
C. *Різниці двох електродних потенціалів
D. Логарифму двох електродних потенціалів
E. Добутку двох електродних потенціалів
683. Якщо в системі, що складається з металу та розчину його солі, переважає процес переходу іонів металу в розчин, то метал заряджається:
A. Заряд нейтралізується
B. Заряд не змінюється
C. Заряд дорівнює нулю.
D. Позитивно
E. *Негативно
684. Ферменти проявляють високу активність і діють в організмі за:
A. Низького атмосферного тиску
B. Високого атмосферного тиску
C. *Температури тіла
D. Високих температур
E. Низьких температур
685. Природними каталізаторами є:
A. Жири
B. Вуглеводи
C. Вітаміни
D. *Ферменти
E. Високомалекулярні сполуки
686. На швидкість гомогенних реакцій не впливає:
A. *Площа поверхні поділу фаз
B. Температура
C. Природа розчинника
D. Концентрація регента
E. Природа реагуючих речовин
687. З наведених тверджень правильним є:
A. Каталізатор не впливає на швидкість реакції
B. Каталізатор зменщує швидкість хімічної реакції
C. Каталізатор входить до складу продуктів реакції
D. *Каталізатори беруть участь в реакції, але не входять до продуктів реакції
E. Каталізатори не беруть участі в реакції
688. В яких випадках має місце каталітична реакція:
A. Швидкість розчинення NaCl збільшується при нагріванні
B. Швидкість реакції горіння фосфору підвищується при внесенні його в атмосферу чистого кисню.
C. *Швидкість реакції розкладу H2O2 зростає при внесенні в нього оксиду мангану.
D. Інтенсивність реакції горіння вугілля зростає після його подрібнення.
E. Швидкість реакції взаємодії водню з бромом збільшується при нагріванні.
689. Каталізатор пришвидшує хімічну реакцію завдяки:
A. Зростанню площі реагента
B. Зменшення теплоти реакції
C. Зростанню теплоти реакції
D. Підвищенню енергії активації
E. *Зниженню енергії активації
690. Речовини, які пригнічують дію каталізаторів, називаються:
A. Індикаторами
B. Неметалами.
C. Металами.
D. *Інгібіторами.
E. Каталізаторами.
691. Речовини, які пришвидшують хімічну реакцію, але самі не витрачаються в реакції, називаються:
A. Індикаторами
B. Неметалами.
C. Металами.
D. Інгібіторами.
E. *Каталізаторами.
692. Із наведених рівнянь реакцій оберіть те, що відповідає гідролізу крохмалю:
A. С6Н12О6 + 6О2→ 6СО2+6Н2О
B. CH3COOC2H5 + H2O ® CH3COOH + C2H5OH.
C. *(C6H10O5)n + nH2O ® nC6H12O6;
D. nCO2 + mH2O ® Cn(H2O)m + nO2;
E. C12H22O11 + H2O ® 2C6H12O6;
693. Розчин йоду забарвлює крохмаль у:
A. Рожевий колір
B. Жовтий колір.
C. Червоний колір;
D. Зелений колір;
E. *Синій колір;
694. Кінцевий продукт гідролізу крохмалю - це:
A. Целюлоза
B. *Глюкоза.
C. Фруктоза;
D. Сахароза;
E. Декстрин;
695. При нагріванні з кислотами крохмаль, як і всі складні вуглеводи:
A. Конденсується
B. Полімеризується
C. *Гідролізує
D. Відновлюється
E. Окислюється
696. Із наведених формул виберіть ту, що відповідає крохмалю:
A. (С5Н10О12)n
B. C12H22O11
C. C2H5OH;
D. C6H12O6;
E. *(C6H10O5)n;
697. Реакція між якими речовинами належить до оборотних реакцій?
A. NaOH, HCl
B. Al, HCl.
C. KOH, CuCl2;
D. K2O, HCl;
E. *N2, O2;
698. Який каталіз називається позитивним?
A. що супроводиться збільшенням об’єму реакційної суміші
B. що супроводиться зміщенням рівноваги праворуч.
C. який супроводиться зміщенням рівноваги ліворуч;
D. що супроводиться зменшенням швидкості реакції;
E. *що супроводжується збільшенням швидкості реакції;
699. Що таке каталіз?
A. зміна швидкості реакції в присутності індикаторів
B. зміна швидкості реакції в присутності активаторів.
C. зміна швидкості реакції в присутності газів
D. зміна швидкості реакції в присутності промоторів
E. *зміна швидкості реакції в присутності каталізаторів
700. Каталізатор впливає на:
A. Підвищення температури
B. Підвищення тиску
C. Зниження температури
D. *Швидкість реакції
E. Розчинність речовин
701. Як називаються речовини, які сповільнюють швидкість хімічних реакцій?
A. Індикатори
B. Активатори.
C. Промотори
D. *Інгібітори
E. Каталізатори
702. Яке твердження неправильне?
A. *Каталізатор не відновлюється по завершенні реакції.
B. Каталізатор характеризується селективністю.
C. Каталізатор не впливає на константу рівноваги.
D. Каталізатор зменшує енергію активації реакції.
E. Каталізатор не впливає на загальну стехіометрію реакції.
703. Яка з нижченаведих схем відповідає паралельній реакції:
A. AВ+О· → АО·+В; СD+AO·→CO·+AD
B. А+В→ М; А+С→N
C. * 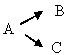
D. А→ В→ С→ Д
E. А+В ↔ С+Д
704. Реакції, які перебігають за участю хімічно-активних частинок називаються:
A. *Ланцюговими
B. Спряженими
C. Паралельними
D. Послідовними
E. Оборотніми
705. Який закон пояснює залежність швидкості хімічної реакції від концентрації реагуючих речовин:
A. *Закон діючих мас
B. Закон Гесса
C. Закон Вант-Гоффа
D. 2й закон термодинаміки
E. 1-й закон термодинаміки
706. Основою якої з теорій каталізу є твердження, що адсорбція реагуючих молекул на каталізаторі залежить від розподілу електронних рівнів всередині кристалів каталізатора і на їх поверхні:
A. Адсорбційна
B. *Електронно-хімічна
C. Теорія активних ансамблів
D. Утворення проміжного комплексу
E. Мультиплетна
707. Яке твердження є правильне?
A. Каталізатор не відновлюється по завершенні реакції.
B. Швидкість реакції не залежить від концентрації
C. Ферменти не є каталізаторами
D. *Каталізатор зменшує енергію активації реакції.
E. Константа швидкості реакції залежить від концентрації речовин
708. Взаємодяї каталізатора і реагентів, при якій швидкість реакції зменшується, називається:
A. Автокаталізом
B. Негативним каталізом
C. *Позитивним каталізом
D. Гомогенним каталізом
E. Гетерогенним каталізом
709. Яка з нижченаведих схем відповідає ланцюговій реакції (беруть участь вільні радикали)
A. *AВ+О· → АО·+В; СD+AO·→CO·+AD
B. А+В→ М; А+С→N
C. 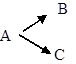
D. А→ В→ С→ Д
E. А+В ↔ С+Д
710. Складні реакції, одна з яких може йти самостійно, а друга перебігає лише, коли проходить перша, називаються:
A. Ланцюговими
B. *Спряженими
C. Паралельними
D. Послідовними
E. Оборотніми
711. Основою якої з теорій каталізу є твердження що поодинокі атоми каталізатора неактивні, але коли вони об’єднуються в невеликі групи, утворюються активні центри:
A. Адсорбційна
B. Електронно-хімічна
C. *Теорія активних ансамблів
D. Утворення проміжного комплексу
E. Мультиплетна
712. Особливість ферментативних реакцій є:
A. Оборотність реакції
B. Випадання осаду
C. *Висока специфічність ферменту
D. Зміна ступеня окиснення ферменту
E. Мала швидкість реакції
713. Взаємодія каталізатора і реагентів, при якій швидкість реакції збільшується, називається:
A. Автокаталізом
B. Негативним каталізом
C. *Позитивним каталізом
D. Гомогенним каталізом
E. Гетерогенним каталізом
714. Яка з нижченаведих схем відповідає послідовній реакції:
A. AВ+О· → АО·+В; D+AO·→CO·+AD
B. А+В→ М; А+С→N
C. 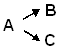
D. *А→ В→ С→ Д
E. А+В ↔ С+Д
715. Реакції, в яких вихідна речовина одночасно реагує в двох напрямках, називається:
A. Ланцюговими
B. Спряженими
C. *Паралельними
D. Послідовними
E. Оборотніми
716. Утворення комплексу ферменту з інгібітором відбувається не на тій ділянці ферменту, з яким зв’язується субстрат, називається:
A. *Неконкурентним інгібуванням
B. Поліконкурентним інгібуванням
C. Конкурентним інгібуванням
D. Безконкурентним інгібуванням
E. Автоконкурентним
717. Основою якої з теорій каталізу є твердження, що окремі атоми в молекулі реагуючої речовини взаємодіють з певними геометрично правильними угрупoваннями атомів або іонів поверхневого шару каталізатора:
A. Адсорбційна теорія
B. Електронно-іонна теорія
C. Теорія активних ансамблів
D. Теорія проміжного комплексу
E. *Мультиплетна теорія
718. Речовини, які гальмують дію каталізатора, називаються:
A. Ферментами
B. Індикаторами
C. Гормонами
D. *Інгібіторами
E. Промоторами
719. Bзаємодія каталізатора і реагентів на поверхні каталізатора називається:
A. Автокаталізом
B. Негативним каталізом
C. Позитивним каталізом
D. Гомогенним каталізом
E. *Гетерогенним каталізом
720. Яка з нижченаведих схем відповідає спряженій реакції:
A. AВ+О· → АО·+В; СD+AO·→CO·+AD
B. *А+В→ М; А+С→N
C. 
D. А→ В→ С→ Д
E. А+В ↔ С+Д
721. Реакції, що одночасно відбуваються у прямому та протилежному напрямках, називаються:
A. Ланцюговими
B. Спряженими
C. Паралельними
D. Послідовними
E. *Оборотніми
722. Явище, коли інгібітор зв’язується з активним центром ферменту і конкурує з субстратом за активний центр. називається:
A. Неконкурентним інгібуванням
B. Поліконкурентним інгібуванням
C. *Конкурентним інгібуванням
D. Безконкурентним інгібуванням
E. Автоконкурентним інгібуванням
723. Основою якої з теорій каталізу є твердження,"каталізатор в процесі реакції бере участь в утворенні нестійкої проміжної сполуки з реагентами":
A. Адсорбційна
B. Електронно-хімічна
C. Теорія активних ансамблів
D. *Утворення проміжного комплексу
E. Мультиплетна
724. Речовини, які підсилюють дію каталізатора називаються:
A. Ферментами
B. Індикаторами
C. Гормонами
D. Інгібіторами
E. *Промоторами
725. Явище взаємодії каталізатора і реагентів в одній фазі називається:
A. Автокаталізом
B. Негативним каталізом
C. Позитивним каталізом
D. *Гомогенним каталізом
E. Гетерогенним каталізом
726. Який прилад використовують для вивчення впливу ступеня дисперсності реагентів у гетерогенних системах на швидкість хімічної реакції?
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 406; Нарушение авторских прав?; Мы поможем в написании вашей работы!