
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Зразок картки контролю знань. KMnO4 + FeSO4 + H2SO4 ® MnSO4 + Fe2(SO4)3 + K2SO4
|
|
|
|
Для реакції:
KMnO4 + FeSO4 + H2SO4 ® MnSO4 + Fe2(SO4)3 + K2SO4...
а) складіть електронні схеми;
б) вкажіть процеси окиснення та відновлення;
в) назвіть окисник та відновник;
г) підберіть коефіцієнти й складіть повне рівняння реакції.
ХІД РОБОТИ
10.1 Окисні властивості калій перманганату в кислому середовищі.
Налийте в чотири пробірки по 1 мл розчину калій перманганату, підкисліть концентрованою сульфатною кислотою (1-2 краплі) і додайте по краплях до зміни кольору розчини:
в першу пробірку - розчину натрій сульфіту Na2SO3, в другу - калій йодиду KІ, в третю - ферум(ІІ) сульфату FeSO4 і в четверту - натрій сульфіду Na2S. Відзначте і поясніть зміни, що відбулися (зміна кольору розчинів, випадання осаду). Складіть рівняння окисно-відновних реакцій.
10.2 Окисні властивості калій дихромату
Проведіть дослід аналогічно попередньому, використавши як окисник розчин калій дихромату K2Cr2O7. Відзначте і поясніть зміни, що відбулися (зміна кольору розчинів, випадання осаду). Складіть рівняння окисно-відновних реакцій.
10.3 Відновлення калій нітрату цинком у лужному середовищі
До 1 мл розчину калій нітрату KNO3 долийте 3 мл
30%-го розчину калій гідроксиду КОН і всипте в розчин пучку порошку цинку. Розчин нагрійте до кипіння і визначте за запахом, який газ утворюється при реакції. Складіть рівняння реакції.
10.4 Взаємодія натрій пероксиду з водою
У пробірку з невеликою кількістю води додайте трохи натрій пероксиду Na2О2. Опустіть в пробірку тліючу скіпку; що спостерігається? Випробуйте розчин фенолфталеїном. Складіть рівняння реакції.
10.5 Відновні властивості двовалентного стануму
До 2 мл розчину станум(ІІ) хлориду SnС12 долийте надлишок розчину натрій гідроксиду до розчинення осаду, що утворився. До одержаного розчину натрій тетрагідроксостанату(ІІ) добавте декілька крапель розчину бісмут(ІІІ) нітрату Bi(NO3)3. Що спостерігається? Складіть рівняння реакцій.
10.6 Окисні властивості натрій нітриту
До 2 мл розчину калій йодиду КІ, підкисленого розведеною сульфатною кислотою, добавте по краплях розчину натрій нітриту NaNO2. Що спостерігається? Складіть рівняння реакції.
10.77 Відновні властивості натрій нітриту
До 1 мл розчину калій дихромату K2Cr2O7додайте декілька крапель концентрованої сульфатної кислоти і 1 мл розчину натрій нітриту NaNO2. Вміст пробірки підігрійте. Що спостерігається? Складіть рівняння реакції.
10.8 Відновлення калій перманганату залежно від рН середовища
В три пробірки налийте по 1-2 мл розчину калій перманганату KMnO4; в одну з пробірок додайте 2-3 краплі розчину сульфатної кислоти, в другу - 1-2 мл концентрованого розчину калій гідроксиду.
У всі три пробірки прилийте по 1-2 мл розчину натрій сульфіту Na2SO3. Що спостерігається? Складіть рівняння реакцій.
ЗАВДАННЯ ДЛЯ САМОСТІЙНОЇ РОБОТИ
Відповідно до варіанта запишіть правильні відповіді на нижчезазначені питання:
Завдання І
а) Визначіть ступінь окиснення підкресленого елемента в сполуках;
б) Вкажіть, які властивості (відновні, окисні, ті і інші) може виявити підкреслений елемент в реакціях.
| В | Сполуки |
| K Cl; Cl 2; K Cl O | |
| K Cl O3; K Cl O4; H2 C 2O4 | |
| K2 Cr 2O7; K2 Cr O4; Cr2 (SO4)3 | |
| Cr (NO3)3; Cr; H C OOH | |
| F2 O; O 2; H2 O | |
| C O2; H2 O 2; C H3OH | |
| K Mn O4; K2 Mn O4; Mn O2 | |
| Mn Cl2; Mn; C H2O | |
| N H3; N 2; N 2O | |
| K N O2; H N O3; C 2H6 | |
| K Cl; Mn O2; K2 Mn O4 | |
| Mn O; K Mn O4; H2 S | |
| S; Fe S; Mn 2O7 | |
| Cl 2; K Cl O3; S O3 | |
| S O2; K Cl O4; H2 S O3 |
Завдання ІІ
Які з нижчезазначених реакцій відносяться до окисно-відновних. Вкажіть їх тип (міжмолекулярна, внутрішньомолекулярна, диспропорціонування):
| В | Реакції |
| CaCO3 = CaO + CO2 | |
| 2KClO3 = 2KCl + 3O2 | |
| CH4 + 2O2 = CO2 + 2H2O | |
| MnO2 + 2KOH + KNO3 = K2MnO4 + KNO2 + H2O | |
| 2KMnO4 + 16HCl = 2MnCl2 + 5Cl2 + 2KCl + 8H2O | |
| MnO2 + 2KOH = K2MnO3 + H2O | |
| MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O | |
| MnCO3 = MnO + CO2 | |
| Mn(ClO4)2 + H2SO4 = Cl2O7 + MnSO4 + H2O | |
| MnCl2 + 2NaOH = Mn(OH)2 + 2NaCl | |
| H2S + 8HNO3 = H2SO4 + 8NO2 + 4H2O | |
| 2H2S + H2SO3 = 3S + 3H2O | |
| 2Pb(NO3)2 = 2PbO + 4NO2 + O2 | |
| 2NaNO3 = 2NaNO2 + O2 | |
| NH4NO2 = N2 + 2H2O |
Завдання ІІІ
Для даних окисно-відновних реакцій:
а) складіть електронні схеми;
б) вкажіть процеси окиснення та відновлення;
в) назвіть окисник та відновник;
г) підберіть коефіцієнти й складіть повне рівняння реакцій.
| В | Реакції |
| Al + NaOH + H2O ® Na[Al(OH)4] + H2 Pb(NO3)2 ® PbO + NO2 + O2 Cu + HNO3(p) ® Cu(NO3)2 +... H2S + SO2 ®... | |
| MnO2 + HCl ® MnCl2 + Cl2 + H2O Mg + HNO3(p) ® NH4NO3 +... KMnO4 + HCl ®... | |
| KOH + Cl2 ® KClO3 + KCl + H2O K2Cr2O7 + HCl ® CrCl3 +... KOH + Cl2 ®... | |
| K2Cr2O7+KІ+H2SO4®Cr2(SO4)3 + І2 + K2SO4+H2O KClO3 + HCl ® Cl2 +... | |
| KMnO4 + KІ + H2SO4 ® MnSO4 + І2 + K2SO4 + H2O K2Cr2O7 + H2S+H2SO4®Cr2(SO4)3 +S +K2SO4 +H2O SO2 + Cl2 + H2O ®... | |
| KІ + H2SO4 ® І2 + KHSO4 + H2S + H2O KMnO4 + SO2 + H2O ® H2SO4 +... K2Cr2O7 + SO2 + H2SO4 ® Cr2(SO4)3 + K2SO4 + H2O | |
| (NH4)2SO4 ® N2 + SO2 + NH3 + H2O K2Cr2O7 + NO + H2SO4 ® HNO3 +... K2Cr2O7 + KNO2 + H2SO4 ®... | |
| KMnO4 +NO+H2SO4®HNO3+MnSO4+K2SO4 + H2O CuS + HNO3 ® Cu(NO3)2 + H2SO4 + NO2 + H2O Zn + HNO3(р) ® NH4NO3 +... P + HNO3 ®... | |
CuS + HNO3 ® Cu(NO3)2 + S + NO + H2O
Fe + HNO3(р) ® NH4NO3 +...
KClO3 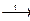 ... ...
| |
| KMnO4+PH3 +H2SO4®H3PO4+MnSO4+K2SO4+ H2O Ca3(PO4)2 + SiO2 + C ® CaSiO3 + CO + P KMnO4 ® K2MnO4 +... Fe + H2SO4(к) ®... | |
FeSO4 +K2Cr2O7+H2SO4 ® Fe2(SO4)3 + Cr2(SO4)3+...
NH4NO2 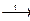 ... ...
| |
| H2S + HNO3 ® H2SO4 + NO2 + H2O K2MnO4 + H2O ® KMnO4 + MnO2 + KOH Al + HNO3(р) ® N2O +... | |
| H2S + HNO3 ® H2SO4 + NO2 + H2O K2MnO4 + H2O ® KMnO4 + MnO2 + KOH Al + HNO3(р) ® N2O +... | |
| H2O2 + NO2 ® HNO3 PbO2 + HCl ® PbCl2 + Cl2 + H2O Zn + KMnO4 + H2SO4 ® MnSO4 +... CrCl2 + O2 + HCl ®... | |
| Sb2O3 + Br2 + KOH ® KSbO3 + KBr + H2O KClO ® KClO3 + KCl KMnO4 + KNO2 + H2O ® MnO2 +... S + HNO3(к) ®... |
11 ХІМІЧНА КІНЕТИКА
(лабораторна робота)
Програмні питання
1. Швидкість хімічних реакцій, в яких одиницях вона вимірюється?
2. 3алежність швидкості хімічних реакцій від концентрацій реагуючих речовин - закон діючих мас.
3. Залежність швидкості хімічних реакцій від температури (правило Вант-Гоффа).
4. Швидкість хімічних реакцій у гетерогенних системах.
5. Хімічна рівновага, константа рівноваги.
6. Принцип Ле Шательє (вміти застосувати його на конкретних прикладах).
7. Каталіз. Гомогенний та гетерогенний каталіз (на конкретних прикладах).
Література
[1], [2], [3], [5], [16]
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 658; Нарушение авторских прав?; Мы поможем в написании вашей работы!