
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Робота № 7/1. Визначити константу швидкості реакції гідратації оцтового ангідриду
|
|
|
|
КІНЕТИКА РЕАКЦІЙ В ГОМОГЕННИХ СИСТЕМАХ
Бімолекулярні реакції в газах. Застосування теорії зіткнень. Реакції з участю складних молекул, стеричний фактор. Застосування теорії активного комплексу для бімолекулярних реакцій у газах.
Мономолекулярні реакції в газах. Застосування теорії активного комплексу до мономолекулярних реакцій. Теорія Ліндемана.
Тримолекулярні реакції з позицій теорії зіткнень та активного комплексу.
Ланцюгові процеси. Нерозгалужені ланцюгові реакції, довжина ланцюга. Механізм та кінетика нерозгалужених ланцюгових реакцій.
Розгалужені ланцюгові реакції, теорія Семенова - Хіншельвуда. Період індукції, граничні явища в розгалужених ланцюгових процесах.
Реакції в розчинах неелектролітів. Вплив розчинника, комірковий ефект. Ланцюгові реакції полімеризації в неводних розчинах.
Реакції в розчинах електролітів. Сольові ефекти. Вплив полярного розчинника на швидкість реакції.
Література: [1-7,14-16].
Мета роботи. Визначити середню константу швидкості реакції.
Методика роботи. У роботі використовують один з електрохімічних методів аналізу для вивчення кінетики реакції:
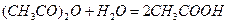 .
.
Ця реакція в розведених водних розчинах проходить як реакція 1-го порядку і практично до кінця. До найбільш зручних методів відноситься метод вимірювання електропровідності під час протікання реакції. Електропровідність системи з часом значно підвищується завдяки утворенню оцтової кислоти.
Концентрацію оцтової кислоти, що утворюється, визначають за величиною електропровідності розчину, яку вимірюють за допомогою містка Кольрауша. Опір розчину Rt визначається за рівнянням
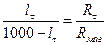 , (1)
, (1)
де Rмаг - опір магазину; lt і (1000 - lt) - довжина плеч реохорду (мм) (див. рисунок до роботи № 10/1).
Якщо позначити електропровідність розчину на момент початку реакції як к0, електропровідність на даний момент часу кt, електропровідність у кінці реакції кµ (коли вона не змінюється), тоді
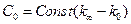 ;
;
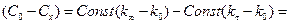
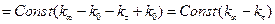 ; (2)
; (2)
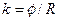 , (3)
, (3)
де j - стала посудини.
Константа швидкості реакції 1-го порядку розраховується за рівнянням
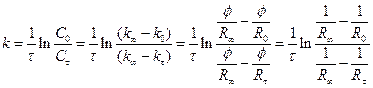 . (4)
. (4)
Опір розчину на момент початку реакції (R0) експериментально не вимірюється, тому що від початку реакції до першого вимірювання проходить певний час. Тому ln(1/Rµ - 1/R0) визначають екстраполяцією, для чого будують графік 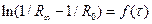 .
.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 335; Нарушение авторских прав?; Мы поможем в написании вашей работы!