
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Робота № 9/1. Дослідження швидкості реакції розкладу пероксиду водню
|
|
|
|
КАТАЛІЗ
Визначення каталізу. Загальні принципи каталізу. Різниця між каталізом та ініціюванням хімічних реакцій. Роль каталізу в промисловості та живій природі.
Гомогенний каталіз. Кислотно-основний каталіз, загальний та специфічний. Рівняння Бренстеда. Механізм кислотно-основного каталізу, пушпульний механізм.
Каталіз окисно-відновних реакцій у розчинах. Каталіз комплексними сполуками перехідних металів.
Гетерогенний каталіз. Визначення швидкості гетерогенно-каталітичної реакції та питома активність каталізатора, правило Борескова. Активність та селективність гетерогенних каталізаторів. Дифузійна та кінетична області проходження гетерогенно-каталітичних процесів.
Кінетика гетерогенно-каталітичних реакцій на однорідних поверхнях, стадії каталітичних процесів. Кінетика реакцій на неоднорідних поверхнях.
Гетерогенні каталізатори. Кислотно-основні каталізатори. Каталізатори окисно-відновних реакцій.
Каталітичні властивості металів. Теорія мультиплетів Баландіна. Нанесені металічні каталізатори, роль носія. Розведені шари, теорія ансамблів Кобозева. Роль структурного фактора в каталізі на металах, структурно чутливі та структурно не чутливі реакції. Каталіз на металічних монокристалах.
Промотори та їх роль у гетерогенному каталізі. Отруєння каталізаторів.
Механізм деяких гетерогенно-каталітичних процесів.
Література: [1-7,14-16,18]
Мета роботи. Визначити константу швидкості реакції та дослідити вплив на неї температури й каталізаторів.
Методика роботи. Пероксид водню самочинно розкладається відповідно до рівняння:
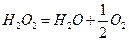 .
.
Реакція розкладу пероксиду є реакцією 1-го порядку. Швидкість реакції вивчають, вимірюючи об'єм кисню, який виділяється через різні проміжки часу від початку реакції (газометричний метод).
Порядок роботи. Схему пристрою, що використовується у роботі, наведено на рисунку.
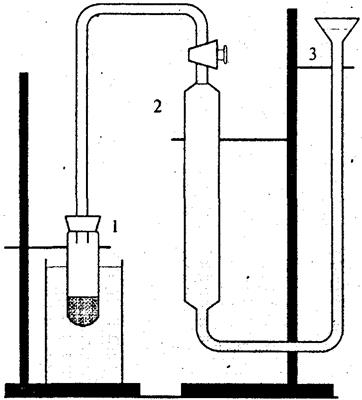
| Схема пристрою для визначення швидкості реакції розкладу пероксиду водню |
У пробірку наливають 5 мл розчину пероксиду водню і розміщують її у термостаті, налагодженому на задану температуру (за вказівкою викладача). Газову бюретку 2 заповнюють водою і встановлюють посудину для вирівнювання рівнів 3 так, щоб за відкритого верхнього крану бюретки рівень води в ній залишався на позначці "0". Щільно закривають пробірку з пероксидом корком, через який пропущено трубку, з'єднану з газовою бюреткою (кран при цьому з'єднує пробірку з атмосферою). Ставлять кран на бюретці у положення, за якого бюретка буде з'єднана з пробіркою, і одночасно включають секундомір (цей момент вважають початком реакції). Коли в бюретці збереться 2-3 мл газу, виконують перше вимірювання: встановлюють однакові рівні рідини у бюретці та зрівняльній посудині, записують рівень рідини у бюретці та час від початку реакції. Коли об'єм газу збільшиться ще на 2-3 мл, роблять наступне вимірювання; знову встановлюють однакові рівні в бюретці та посудині 3 і так далі до закінчення виділення газу. При роботі з каталізатором 5 мл розчину каталізатора розміщують у окремій пробірці у термостаті, витримують близько 10 хв, потім вливають у розчин пероксиду водню. Після цього виміри проводять так, як з розчином пероксиду без каталізатора. Яккаталізатори використовують розчини йодиду калію, хлоридів заліза та міді різних концентрацій. Результати вивчення швидкості реакціїї зводять у таблицю
| Час від початку реакції | Об'єм кисню V, мл | 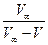
| 
| k |
Константу швидкості реакції розраховують або за допомогою рівняння
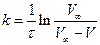 ,
,
або графічно, виходячи з кута нахилу прямої у координатах 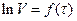 (константа швидкості реакції дорівнює тангенсу кута нахилу), де V∞ - кінцевий об'єм кисню, що виділився.
(константа швидкості реакції дорівнює тангенсу кута нахилу), де V∞ - кінцевий об'єм кисню, що виділився.
Література: [24].
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 701; Нарушение авторских прав?; Мы поможем в написании вашей работы!