
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
На фотоелектроколориметрі аміачним методом
Завдання 1.Визначення вмісту міді в розчині купруму (II) сульфату
Експериментальна частина
Підбір кювети
Залежність кольору світлофільтра від довжини хвилі
Підбір світлофільтрів
Світлофільтр поглинає із світлового потоку ті промені, які не поглинає розчин. Необхідно підбирати такий світлофільтр, який найбільш повно поглинає промені. Для підбору світлофільтра замірюють абсорбційність концентрованого стандартного розчину на всіх восьми світлофільтрах. Визначення проводять із тим світлофільтром, який показує максимальну чутливість приладу.
Орієнтовано світлофільтри можна підбирати, користуючись даними наведеними в таблиці 1.
Таблиця 1.
| Колір розчину | Світло-фільтр | Область довжини хвилі, нм | Колір розчину | Світло-фільтр | Область довжини хвилі, нм |
| Жовто – зелений | Фіолето- вий | 400-450 | Фіолето-вий | Жовто-зелений | 560-575 |
| Жовтий | Синій | 450-480 | Синій | Жовтий | 575-590 |
| Оранже- Вий | Зелено-синій | 480-490 | Зелено-синій | Оранже-вий | 590-625 |
| Червоний | Синьо-зелений | 490-500 | Синьо-зелений | Червоний | 625-750 |
| Пурпуро- Вий | Зелений | 500-560 |
Попередньо вибір кювет проводиться візуально, відповідно інтенсивності забарвлення. Якщо розчин інтенсивно забарвлений (темний), то треба використовувати кювети з малою робочою довжиною (10-30 мм). Для розбавлених розчинів рекомендується підбирати кювети з великою робочою довжиною (30-50 мм). При визначенні вхідна й вихідна робоча поверхні повинні бути чистими, без плям. Перед тим, як вставити кювету в кюветотримач, необхідно протерти її фільтрувальним папером.
Кювету треба підбирати таку, щоб для стандартного розчину оптична густина не перебільшувала 1, бо пряма залежність адсорбції спостерігається від 0 до 1. Для цього і вимірюють адсорбційність вихідного стандартного розчину в кюветах різної робочої довжини.
Підготовка досліджуваного розчину
Ця операція включає виконання хімічної реакції за методикою, яка є специфічною для кожного визначення. Треба дуже точно дотримуватись вказаного в методиці порядку подачі реактивів, їх концентрації, температури та інших факторів, які впливають на протікання реакції.
Вимірявши оптичну густину досліджуваного розчину і відклавши одержане значення на калібрувальному графіку, визначимо концентрацію досліджуваного розчину.
Цей метод оснований на реакції взаємодії катіонів Cu2+ з надлишком розчину аміаку:
Cu2+ + 4NH3•H2O = [Cu(NH3)4]2++ 4H2O
Комплексний йон [Cu(NH3)4]2+ має інтенсивний синій колір.
Підготовка серії стандартних розчинів
Для приготування серії стандартних розчинів готують еталонний розчин купрум (ІІ) сульфату. Для цього розрахуємо необхідну кількість хімічно чистого купрум (ІІ) сульфату таким чином, щоб 1 дм3 розчину містив 1 г Cu2+, або в 1 см3 розчину містилось 1 мг Cu2+.
М (CuSO4•5H2O) = 249,68 г/моль;
249,68 г CuSO4•5H2O містить 63,546 г Cu2+
Х г CuSO4•5H2O містить 1 г Cu2+
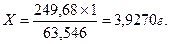
На аналітичних терезах зважують точно 3,9270 г CuSO4•5H2O. Кількісно переносять у колбу, розчиняють у воді, додають 5,0 см3 концентрованої H2SO4 (ρ= 1,84 г/ см3) і доводять водою до мітки 1 дм3 дистильованою водою.
Для побудови калібрувального графіка готують стандартні розчини. Спочатку готують розчин максимальної концентрації. Для цього в мірну колбу об’ємом 100 см3 відбирають піпеткою 25,00 см3 еталонного розчину, додають 10,00 см3 розведеного (1:3) розчину NH3•H2O, доводять водою до мітки, перемішують і переливають в конічну колбу. За цим розчином підбирають умови роботи. Потім готують у тій же мірній колбі решту розчинів, відбираючи піпеткою відповідно 20,0; 15,0; 10,0; 5,0; 2,50 см3 еталонного розчину і по 10,00 см3 розведеного (1:3) розчину аміаку.
Для кожного розчину вимірюють абсорбційність 3-4 рази, находять середнє значення. Одержані дані вносять у таблицю 2
Таблиця 2.
Дата добавления: 2015-05-24; Просмотров: 533; Нарушение авторских прав?; Мы поможем в написании вашей работы!