
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Справочный материал
|
|
|
|
Изучение термодинамического процесса
Практическое занятие №5
Цель работы: изучить термодинамические газовые процессы
При исследовании термодинамических процессов используются уравнение состояния идеальных газов и математическое выражение первого закона термодинамики. В общем случае любые два термодинамических параметра из трех могут изменяться произвольно. Термодинамика изучает пять основных процессов идеальных газов:
1.изохорный, (v= const) происходящий при постоянном объеме газа;
2.изобарный, (р = const) происходящий при постоянном давлении;
3.изотермический, (Т = const) происходящий при постоянной температуре;
4.адиабатный, (q = 0) протекающий без подвода или отвода теплоты, т.е. протекающий без теплообмена с окружающей средой;
5.политропный — обобщенный процесс изменения всех параметров рабочего тела при наличии теплообмена; для него четыре предыдущих процесса являются частными случаями.
Для изучения этих процессов необходимо определить:
уравнение процесса, которое устанавливает закономерность изменения состояния рабочего тела; графическое изображение процесса в диаграммах; связь между параметрами в процессе; изменение внутренней энергии рабочего тела в процессе; работу, совершаемую рабочим телом в процессе; теплоту, участвующую в процессе.
Изохорный процесс Такой процесс может совершаться рабочим телом, находящимся в цилиндре при неподвижном поршне, если к рабочему телу подводится теплота от источника теплоты (см. рис.1) или отводится теплота от рабочего тела к холодильнику. При изохорном процессе выполняется условие dv=0 или v=const. Уравнение изохорного процесса получим из уравнения состояния идеального газа при v=const. Уравнение изохорного процесса: v = const.
 Графически в p-v-диаграмме изохорный процесс изображается линией, параллельной оси давлений Линии изохорного процесса в диаграмме состояния называется изохорой.
Графически в p-v-диаграмме изохорный процесс изображается линией, параллельной оси давлений Линии изохорного процесса в диаграмме состояния называется изохорой.
Связь между параметрами в изохорном процессе подчиняется закону Шарля
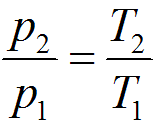
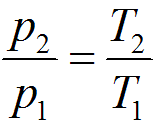
И изохорном процессе вся подведенная теплота расходуется на изменение внутренней энергии тела. Для тела с произвольной массой вещества m имеем: 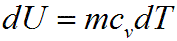

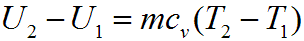
где cv — средняя массовая изохорная теплоемкость в интервале температур от T1, до Т2.
Теплоемкостью называется количество теплоты, которое следует подвести к единице количества вещества для нагревания его на 1 градус. Массовая теплоемкость выражается в кДж/(кг • К), объемная — в кДж/(м3 • К), мольная — в кДж/(кмоль • К).
Так как в изохорном процессе нет изменения объема, то и работа по его изменению не совершается: W1-2 = 0.
Количество теплоты, подведенное в изохорном процессе, равно изменению внутренней энергии. Для произвольной массы вещества: 
Изобарный процесс. Уравнение изобарного процесса р= const.
Графически изобарный процесс в р—v-диаграмме изображается прямой линией, параллельной оси объемов. Линия изобарного процесса называется изобарой.
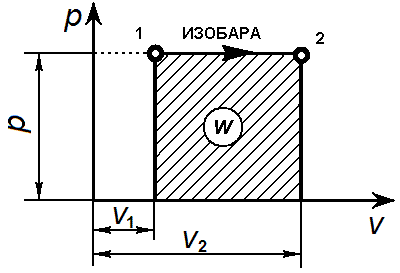 Связь между параметрами в изобарным процессе выража ется законом Гей-Люссака:
Связь между параметрами в изобарным процессе выража ется законом Гей-Люссака:
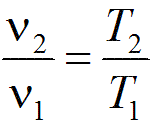
Изменение внутренней энергии газа рассчитывается по формуле: 
В изобарном процессе происходит изменение объема рабочего тела, следовательно, совершается работа, определяемая: 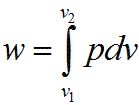
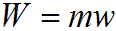
Для произвольной массы газа m формула работы примет:
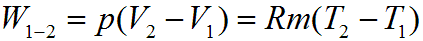
где V1, V2 - объем m кг газа в начале и конце процесса, м3.
Воспользовавшись первым законом термодинамики, можем рассчитать теплоту процесса (для 1 кг газа) по формуле:
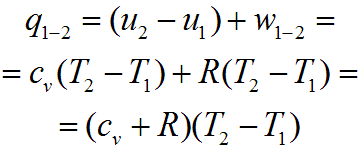
При этом в термодинамике существует связь между изохорной cv и изобарной ср теплоемкостями. Связь устанавливается уравнением Майера: 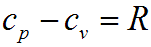
Тогда выражение для определения количества теплоты для 1 кг газа примет вид:
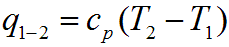
для произвольной массы газа: 
Таким образом, в изобарном процессе теплота расходуется на совершение работы и на изменение внутренней энергии рабочего тела.
Изотермический процесс. Уравнение изотермического процесса: Т= const или pv = const.Графически изотермический процесс в р—v-диаграмме изображается в виде равнобокой гиперболы что вытекает из уравнения pv = const, и называется изотермой.
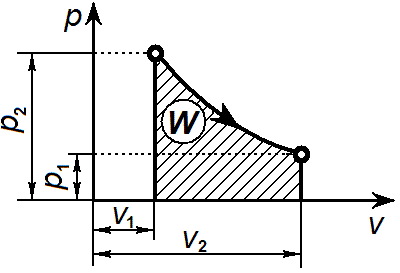 Связь между параметрами изотермического процесса определяется законом Бойля — Мариотта:
Связь между параметрами изотермического процесса определяется законом Бойля — Мариотта: 
Так как Т1 = Т2, изменение внутренней энергии газа в изотермическом процессе равно нулю: 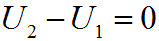
Совершенная 1 кг газа работа в изотермическом процессе, c учетом того что RT = const, определяется следующим образом:

Пользуясь законом Бойля — Мариотта, получим: 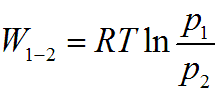
Для произвольной массы рабочего тела уравнение работы примет вид:
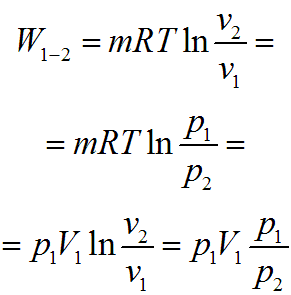
Графически в p-v диаграмме работа в процессе 1-2 определяется площадью под изотермой.
Теплота, участвующая в изотермическом процессе, определится соотношением:
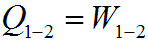
Это означает что вся подведенная в изотермическом процессе теплота расходуется на совершение работы.
Адиабатный процесс. Уравнение адиабатного процесса имеет вид: 
где k =cp/cv -показатель адиабаты для идеального газа.
Графически адиабатный процесс на p-v-диаграмме изображается неравнобокой гиперболой, называемой адиабатой. Адиабата круче изотермы, так как к > 1.
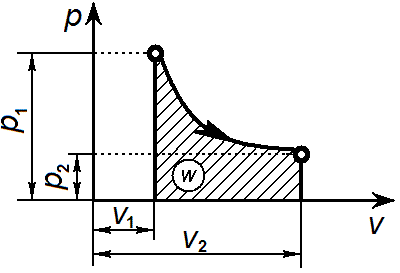 Связь между параметрами процесса определяется, используя уравнение адиабаты и уравнение состояния газа pv = RT:
Связь между параметрами процесса определяется, используя уравнение адиабаты и уравнение состояния газа pv = RT:
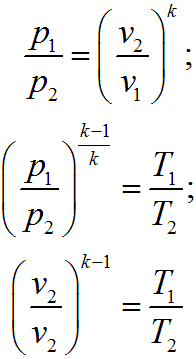
Изменение внутренней энергии для т кг вещества определяется по формуле:
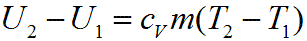
Работа в адиабатном процессе, совершенная 1 кг газа, может быть определена из уравнения первого закона термодинамики: 
Так как в адиабатном процессе q=0, то:
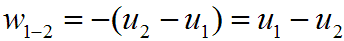 и
и 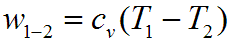
то есть работа расширения в адиабатном процессе совершается за счет уменьшения внутренней энергии газа.
Адиабатный процесс протекает без подвода теплоты, следовательно Q=0.
Политропный процесс
Уравнение политропного процесса имеет вид 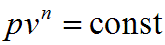
где n - показатель политропы, который изменяется для разных процессов от 0 до + бесконечности.
Рассмотренные ранее процессы являются частными случаями иолитроппых процессов:
 если n = к, то pvk = const — адиабатный процесс;
если n = к, то pvk = const — адиабатный процесс;
если n = 1, то pv = const — изотермический процесс;
если n = 0, то pv0 = p = const — изобарный процесс;
если n ±?, то представив pvn = const как рn v = const, имеем v=const — изохорный процесс.
Показатель изотропы n можно определить, если известны два состояния политропном процесс
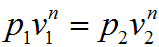
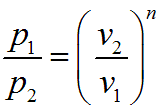
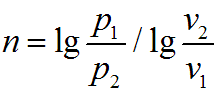
Графическое изображение политропного процесса в р—v-диаграмме имеет вид кривой, которая называется политропой. Соотношение параметров данного процесса можно получить, заменив в уравнениях адиабатного процесса показатель степени k на показатель n:
Изменение внутренней энергии в политропном процессе для произвольной массы вещества определяется по формуле 
Работа изменения объема в политропном процессе для 1 кг рабочего тела равна  или, учитывая уравнение состояния Клапейрона,
или, учитывая уравнение состояния Клапейрона,

Для произвольной массы газа 
Количество теплоты в политропном процессе для m кг вещества определяется выражением, полученным в соответствии с первым законом термодинамики


Задание: записать в отчет данные о термодинамических процессах
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 674; Нарушение авторских прав?; Мы поможем в написании вашей работы!