
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Результаты работы
|
|
|
|
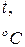
| T, K | %CO | 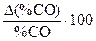
| 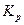
| 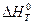 , ,
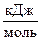
| 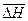 , ,
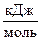
| ||
| (%CO) оп ± ±Δ(%CO) | %СО расч | 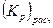
| 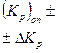
| |||||
По данным таблицы 1 строят график зависимости 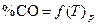 и формулируют общие выводы по результатам работы.
и формулируют общие выводы по результатам работы.
Вопросы для самоконтроля
1. Что означает термин «число степеней свободы (с)» равновесной системы; какие данные необходимы для расчета с?
2. Углерод, растворенный в железе, реагирует с СО2 по реакции 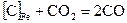 .
.
Определите число степеней свободы системы.
3. Какое состояние называют стандартным для компонента газовой смеси и для чистого конденсированного вещества?
4. Используя уравнение изобары, докажите, что равновесие эндотермической реакции смещается с ростом температуры при постоянном давлении в сторону образования продуктов реакции.
5. При давлении 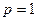 атм и температуре Т равновесное содержание СО в газовой фазе составило 40%. Возможно ли протекание реакции газификации, если при заданных р и Т исходная газовая смесь содержит 2 моля СО2 и 3 моля СО?
атм и температуре Т равновесное содержание СО в газовой фазе составило 40%. Возможно ли протекание реакции газификации, если при заданных р и Т исходная газовая смесь содержит 2 моля СО2 и 3 моля СО?
6. Поясните принцип работы газоанализатора; как рассчитывается концентрация монооксида углерода в газовой фазе?
Работа № 2. ИЗУЧЕНИЕ УПРУГОСТИ ДИССОЦИАЦИИ CaCO3
Целью работы является изучение температурной зависимости упругости диссоциации карбоната кальция и определение теплового эффекта реакции диссоциации CaCO3.
Процессы диссоциации карбонатов имеют большое распространение в металлургии, например, в процессах обжига известняка; разложения известняка в доменной печи, где он употребляется в качестве флюса.
Теоретическая часть
Карбонат кальция, являющийся основной составной частью мела, известняка, мрамора, диссоциирует по реакции
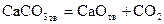 . .
| (25) |
Будем считать, что система состоит из чистых CaCO3, CaO и CO2 и между ними протекает только реакция (25).
Равновесное давление двуокиси углерода 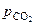 над карбонатом называют его упругостью диссоциации.
над карбонатом называют его упругостью диссоциации.
Число параметров, определяющих состояние равновесия системы, можно найти по правилу фаз Гиббса:
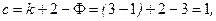
| (26) |
где – k число независимых компонентов в системе; Ф – число фаз.
Система обладает одной степенью свободы, то есть из двух параметров, определяющих состояние системы (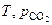 ), один можно изменять произвольно, не меняя количества и природы фаз, характерных для равновесия данной системы. Удобнее в качестве независимой переменной выбрать температуру, тогда
), один можно изменять произвольно, не меняя количества и природы фаз, характерных для равновесия данной системы. Удобнее в качестве независимой переменной выбрать температуру, тогда 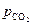 будет её однозначной функцией. Найдем эту функциональную зависимость.
будет её однозначной функцией. Найдем эту функциональную зависимость.
Константа равновесия реакции (25) запишется так:
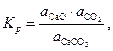
| (27) |
где 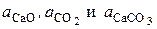 – активности соответствующих реагентов.
– активности соответствующих реагентов.
Известно, что карбонат и оксид кальция весьма мало взаимно растворимы. Поэтому обычно оксид и карбонат находятся в виде самостоятельных твердых фаз, и при небольших давлениях 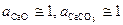 . Активность газообразного СО2 (
. Активность газообразного СО2 (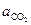 ) определяется соотношением фугитивностей
) определяется соотношением фугитивностей 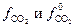 :
:
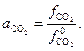
| (28) |
Если давление измерять в атмосферах, то фугитивность в стандартном состоянии 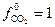 атм и
атм и 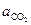 будет численно равна равновесной фугитивности
будет численно равна равновесной фугитивности 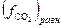 . Поскольку в наших условиях СО2 можно считать идеальным газом, то
. Поскольку в наших условиях СО2 можно считать идеальным газом, то 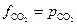 . Таким образом:
. Таким образом:
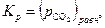
| (29) |
то есть константа равновесия реакции (25) численно равна упругости диссоциации CaCO3, если последняя выражена в атмосферах.
Для анализа зависимости 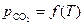 воспользуемся уравнением изобары химической реакции
воспользуемся уравнением изобары химической реакции
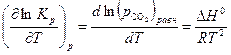
| (30) |
Для процесса диссоциации тепловой эффект 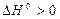 , поэтому упругость диссоциации растет с увеличением температуры. Изменение упругости диссоциации с температурой показано на рис. 4.
, поэтому упругость диссоциации растет с увеличением температуры. Изменение упругости диссоциации с температурой показано на рис. 4.
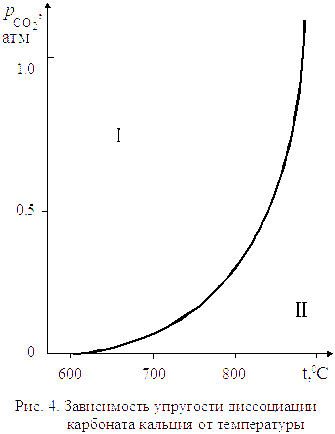 Линия на рис. 4 характеризует условия равновесного сосуществования трех фаз:
Линия на рис. 4 характеризует условия равновесного сосуществования трех фаз: 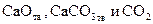 . Если начать изменять не один параметр, как разрешает правило фаз Гиббса, а два, то есть произвольно изменять и температуру, и давление, равновесие системы будет нарушено. Области I и II на графике характеризуют условия равновесного сосуществования уже только двух фаз (одной твердой и газообразной).
. Если начать изменять не один параметр, как разрешает правило фаз Гиббса, а два, то есть произвольно изменять и температуру, и давление, равновесие системы будет нарушено. Области I и II на графике характеризуют условия равновесного сосуществования уже только двух фаз (одной твердой и газообразной).
Для области I характерны давления СО2 бόльшие, чем равновесные значения.
Следовательно, по уравнению изотермы 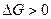 :
:
  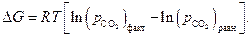
| (31) |
Отсюда можно заключить, что в данных условиях протекает процесс карбонизации
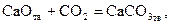
| (32) |
а прямой процесс (диссоциация) невозможен. Иначе говоря, в области I устойчивой фазой является карбонат кальция. Таким образом, если при 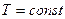 величина
величина 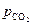 станет больше, чем
станет больше, чем 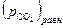 , то это приведет к исчезновению оксидной фазы.
, то это приведет к исчезновению оксидной фазы.
Проведя аналогичные рассуждения для области II, где 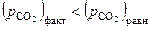 , можно заключить, что при давлениях ниже равновесного
, можно заключить, что при давлениях ниже равновесного 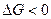 и развитие процесса диссоциации возможно. Устойчивой фазой является в области II оксид кальция
и развитие процесса диссоциации возможно. Устойчивой фазой является в области II оксид кальция 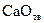 .
.
Поскольку упругость диссоциации, выраженная в атмосферах, численно равна константе равновесия реакции, то ее значение можно теоретически рассчитать по уравнениям (21–24).
Величину теплового эффекта при данной температуре (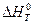 ) можно рассчитать по уравнению Кирхгофа (23).
) можно рассчитать по уравнению Кирхгофа (23).
Среднюю величину теплового эффекта реакции в изученном интервале температур (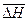 ) можно также оценить по опытным значениям константы равновесия при разных температурах (см. прил.2).
) можно также оценить по опытным значениям константы равновесия при разных температурах (см. прил.2).
При анализе экспериментальных данных и их сопоставлении с рассчитанными по уравнениям (21–24) следует иметь в виду, что на величину упругости диссоциации оказывает влияние дисперсность твердых фаз. При измельчении твердой фазы возрастает ее энергия Гиббса, поскольку увеличивается доля частиц, располагающихся на поверхности кристаллов и обладающих избытком энергии. Принимая во внимание, что общее изменение энергии Гиббса по реакции равно
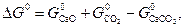
| (33) |
можно заключить, что при измельчении исходной фазы – карбоната (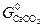 растет) величина
растет) величина 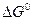 уменьшается, а при измельчении продукта реакции (растет
уменьшается, а при измельчении продукта реакции (растет 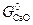 )
) 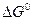 увеличивается. Соответственно, в первом случае
увеличивается. Соответственно, в первом случае 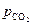 растет, а во втором падает, поскольку
растет, а во втором падает, поскольку
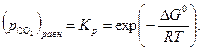
| (34) |
Методика и порядок проведения опытов
Для определения упругости диссоциации CaCO3 в работе используется статический метод. Суть его заключается в непосредственном измерении при данной температуре равновесного давления СО2 в установке.
Схема установки представлена на рис. 5. В электрическую печь сопротивления 1 помещают кварцевую ампулу 2, в которую помещена навеска карбоната 3. Перед началом нагрева печи из ампулы откачивают воздух форвакуумным насосом 4.
После выключения насоса в него надо обязательно запустить воздух с помощью крана 5. |
Кран 5 может быть заменен струбцинами, пережимающими шланги. После этого задатчиком терморегулятора 6 устанавливают первую заданную температуру. Когда заданная температура достигнута (при этом лампочка на терморегуляторе начнет мигать), делают выдержку не менее 10 минут и измеряют давление СО2 в системе с помощью манометра 8. Изотермическая выдержка системы проводится для достижения системой равновесия. При этом, по мере развития реакции, изменяется (увеличивается) давление, а объем реакционного пространства остается постоянным. Следовательно в данном случае процесс проходит при постоянном объеме(V=const). Измеряемая в процессе работы 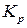 определяется равновесным составом, который не зависит от пути процесса, а определяется элементным составом системы, давление и температурой. Потому
определяется равновесным составом, который не зависит от пути процесса, а определяется элементным составом системы, давление и температурой. Потому 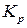 определенную в ходе работы можно анализировать с помощью уравнения изобары и сравнивать с рассчитанной.
определенную в ходе работы можно анализировать с помощью уравнения изобары и сравнивать с рассчитанной.
Измерение упругости диссоциации карбоната кальция следует провести при 4-6 температурах по указанию преподавателя.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 730; Нарушение авторских прав?; Мы поможем в написании вашей работы!
