
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Порядок выполнения работы. Работа выполняется на виртуальной модели, которые часто применяются в случае, если изучение объекта экономически не обосновано
|
|
|
|
Работа выполняется на виртуальной модели, которые часто применяются в случае, если изучение объекта экономически не обосновано, осложнено экспериментально или не безопасно. Виртуальная модель включает в себя смысловую модель, на основе которой разрабатывается математическая модель. По уравнениям мат. модели с помощью компьютера осуществляется графическое представление процесса.
Выполняемая виртуальная работа основана на реальном процессе выделения ионов меди из водного раствора при соприкосновении данного раствора с органической фазой представляющей собой раствор Д2ЭГФК (Ди 2-этил-гексил фосфорная кислота) 30 мас.% в керосине. При протекании такого процесса основное количество Cu2+ переходит в органическую фазу, а концентрация Cu2+ в водном растворе существенно снижается.
Для выполнения работы следует подать в емкость 1 (Рис.8) по трубке 3 с помощью нажатия соответствующей кнопки-клапана необходимое кол-во водного раствора Vр (от 100 до 190 мл, синего цвета), добавить клапаном 4 жидкой органической фазы. После чего включить магнитную мешалку и перемешать растворы в течение 30 сек.
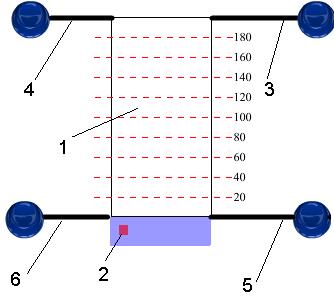
Рис. 8. Схема установки для разделения ионов меди между двумя несмешивающимися жидкостями: 1 – емкость для разделения (экстрактор), 2 – кнопка включения магнитной мешалки, трубки для подачи/слива: 3 – водного раствора содержащего ионы меди, 4 – органической фазы, 5 – на отбор проб для титрования, 6 – растворов в отстойник
Затем полученной эмульсии дают отстояться, и когда установятся два слоя, нижний (воду) в количестве 20 мл сливают нажатием на клапан трубки 5 в колбу для титрования 7 (Рис.9).
С помощью клапана 8 в бюретку 9 заливают титрующий раствор (водный раствор тиосульфата натрия) до выбранного уровня. К исследуемому раствору в колбе 7 добавляют 2 г KJ и 2 мл крахмала с помощью кнопки 10. При добавлении избытка KJ в исследуемый раствор вся медь содержащаяся в нем превращается в иодид и осаждается на дно сосуда.
| 2Cu 2+ +4I- = 2 CuI + I2 | (47) |
В ходе этой реакции происходит выделение молекулярного йода J2, который в присутствии крахмала придает раствору ярко синюю окраску.
Далее с помощью крана 11 начинают титрование, приливая титрующий раствор из бюретки в колбу 7. При этом осуществляется реакция:
| I2 + 2 Na2S2O3 = 2 NaI + Na2S4O6. | (48) |
Тиосульфат натрия взаимодействует с йодом, уменьшая его количество. В момент времени, когда весь молекулярный йод прореагирует по реакции (48), окраска раствора резко изменит свой цвет с синего на бесцветный. Как только раствор обесцветился титрование прекращают и фиксируют потраченное количество титрующего раствора Vт. Зная концентрацию тиосульфата натрия (Na2S2O3) в титрующем растворе, равную 0,1 моль/л, рассчитывают по реакциям (1 и 2) концентрацию меди в исследуемом растворе Ср1. В соответствии с реакцией (47) 2 моля прореагировавших ионов меди приходится 1 моль выделившегося иода. И по реакции (48) для нейтрализации 1 моля иода необходимо 2 моля тиосульфата натрия.
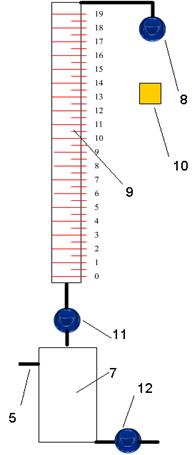
Рис. 9. Схема установки для титрования
7 – колба, 9 – бюретка, 10 – добавление KJ,
8,11, 12 – клапаны
То есть 1 моль прореагировавших Cu2+ приведет к затратам при титровании 1 моль Na2S2O3:
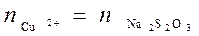 . .
| (49) |
Следовательно концентрацию Ср1 можно определить по формуле:
| С р1= 0,1* V т/20. | (50) |
При выполнении работы на экране в правом нижнем углу отображается начальная концентрация ионов меди в растворе подаваемом в экстрактор C0 от 0,01 до 0,05 моль/л. До процесса экстракции водный раствор содержал количество меди равное 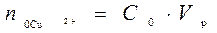 . После того как произошло перераспределение, в растворе остались ионы меди в количестве
. После того как произошло перераспределение, в растворе остались ионы меди в количестве 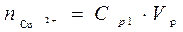 . Следовательно в органическую фазу перешло количество меди равное
. Следовательно в органическую фазу перешло количество меди равное 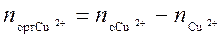 . Зная перераспределившееся количество меди, определяют равновесную концентрацию меди в органической фазе С р2.
. Зная перераспределившееся количество меди, определяют равновесную концентрацию меди в органической фазе С р2.
В емкости, где происходит разделение, остался раствор в количестве достаточном для повторного осуществления операции титрования. Поэтому клапаном 12 сливают из колбы 7 раствор после титрования и проводят химический анализ повторно. Определение концентрации меди в исследуемом растворе осуществляют 3 раза. По результатам трех измерений определяют средние значения концентраций.
Используя уравнение (46) находят коэффициент распределения ионов меди между водой и органической фазой для одной равновесной концентрации ионов меди в воде. Изменяя соотношения объемов органической фазы и водной (водный раствор добавляется в количестве 190, 180, 170, 160, 150 мл; органический до метки в 200 мл), изменяют равновесную концентрацию ионов меди. Определяют зависимость коэффициента распределения L от концентрации. Результаты измерения и расчетов помещают в таблицу 5.
Таблица 5
Результаты работы
| № опыта | Количество раствора тиосульфата, V, мл | Концентрация, моль/л | Коэффициент распределения L | |||||
| № пробы | V ср, мл | С 0 | С р1 | С р2 | ||||
Вопросы для самоконтроля
1. Что называют константой распределения; от каких факторов зависит константа распределения?
2. Что называют коэффициентом распределения; в каком случае коэффициент распределения не зависит от состава раствора?
3. Чему равно число степеней свободы системы, состоящей из двух несмешивающихся индивидуальных жидкостей и распределенного между ними третьего вещества?
4. В каком случае по результатам опытов можно говорить о независимости коэффициента распределения от состава раствора?
5. В условиях задачи требуется очистить изоамиловый спирт от уксусной кислоты при помощи 1 литра воды. Коэффициент распределения равен 1. Как выгоднее ее использовать для этой цели: залить ли ее всю в делительную воронку сразу или отдельными порциями?
6. Изменится ли коэффициент распределения, если между двумя несмешивающимися фазами поместить третью фазу?
7. В чем состоит практическое значение определения коэффициента распределения вещества в двух несмешивающихся жидкостях?
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 407; Нарушение авторских прав?; Мы поможем в написании вашей работы!