
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретические сведения. р-элементыазот, фосфор, мышьяк, сурьма и висмут занимают главгую подгруппу V группы
р-элементыазот, фосфор, мышьяк, сурьма и висмут занимают главгую подгруппу V группы.
В наружной электронной оболочке атомы этих элементов содержат пять электронов, которые имеют следующую электронную формулу: ns2np3 и распределены следующим образом:
ns np





 |  |  |  |
Наличие трех неспаренных электронов в наружной электронной оболочке говорит о том, что в нормальном, невозбужденном состоянии атомы элементов главной подгруппы имеют валентоность III.
В возбужденном состоянии один из s-электронов внешнего слоя переходит на свободную d-орбиталь, что приводит к образованию пяти неспаренных электронов:
ns np nd

|

| 
| 
|

|
Таким образом, для элементов Vа группы в возбужденном состоянии валентность равна V. Исключением является азот, ввиду отсутствия у него d-подуровня. Элементы данной подгруппы проявляют степени окислении: -3, -1, 0, +1, +3, +5.
С водородом азот, фосфор и мышьяк образуют полярные соединения типа RН3, проявляя отрицательную степень окисления. С более электроотрицательными элементами, например, с кислородом, они образуют оксиды типа R2О5, проявляя тем самым высшую положительную степень окисления (+5).
Это более активные металлоиды, чем четвертая группа. Сверху вниз по подгруппе увеличивается радиусы атомов и ионов, а ионизационные потенциалы уменьшаются, поэтому, увеличиваются металлические и восстановительные свойства. У сурьмы и висмута металлические свойства превалируют над неметаллическими. Наиболее характерным неметаллом относят азот.
Азот составляет около 4/5 атмосферы воздуха, которая состоит на 78,2% из азота, 21% кислорода и 1% инертных газов. Он также входит в состав минералов: NaNO3- чилийской селитры и KNO3 – индийской селитры.
Электронная конфигурация азота: 1s2 2s2 2p3

 2s 2p
2s 2p
 |  |  |  |  |




Особенности строения атомов азота N и молекул азота N2:
1. Атом азота содержит три неспаренных электрона, которые могут участвовать в образовании трех ковалентных связей.
2. Атом азота имеет четыре валентные орбитали, которые могут находиться в sp3 sp2 sp - гибридном состоянии. Отсюда, его ковалентность равна 4
3. Атомы азота друг с другом образуют 3 ковалентных связи: одну σ и две π: 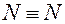
Поэтому молекула N 2 –прочна, химически малоактивна (инертна), все реакции с N 2 протекают при T>1000 C. Молекула азота не имеет электрического дипольного момента (связь в ней неполярна), между молекулами азота действуют слабые дисперсионные силы Ван-дер-Ваальса, что является причиной низких температур кипения и плавления, и малой растворимости в воде.
N2 – инертный газ без запаха и вкуса, мало растворим в воде.
В промышленности азот получают фракционной перегонкой (испарение жидкого воздуха) при Ткип = -195,8оC и Tкип = -183о C, при этом раньше испаряется азот, а кислород остается. Азот собирают в баллонах при высоком давлении.
В лаборатории азот чаще всего получают термическим разложением солей аммония:
NH4NO2 → N2 + 2H2 O
(NH4)2Cr2O7= N2 + Cr2O3+ 4H2O
И пропусканием воздуха над раскаленной медью:
2N2 + O2 + 2Cu = 2 CuO + 4N2
При обычных условиях азот реагирует только с литием:
6Li + N2 = 2Li3N
При нагревании азот взаимодействует и с другими металлами, образуя нитриды:
3Mg + N2 = Mg3+2 N2-3
При очень высокой температуре взаимодействует с кислородом, хлором и фтором:
 N2 + O2 эл. заряд NO
N2 + O2 эл. заряд NO
F2 + N2 → NF3
Cl2 + N2→ NCl3
При оптимальных условиях (t = 4500С и Р=1000 атм) взаимодействует с водородом, образуя аммиак:
N2 + 3H2 → 2NH3
Водородные соединения азота - нитрид азота – H3N или аммиак -NH3(азот имеет степень окисления -3) в промышленности получают путем взаимодействия азота с водородом:
N2 + 3H2 = 2NH3
В лаборатории - путем взаимодействия хлорида аммония с основаниями:
2NH4Cl + Ca(OH)2 = CaCl2 + 2H2O + 2NH3
Атом азота в NH3 (H3N) находится в sp3 гибридном состоянии, на четвертой орбитали находится неподеленная пара электронов; валентный угол H-N-H составляет 107о, близок к тетраэдрическому (рис. 7).
NH3 - бесцветный газ, с сильным запахом, хорошо растворим в воде.
Рис. 7. Строение молекулы аммиака.
Наличие заряда на атоме водорода и неподеленной пары электронов у атома азота объясняются следующие особенности химических свойств аммиака:
1. Способность отщеплять и присоединять ион H+ (протон):
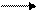 2NH 3 NH 4 + + NH2-
2NH 3 NH 4 + + NH2-
катион аммония амид ион
2. Гидроксид аммония - NH3∙H2O - слабое основание (Kb = 1,8∙10-5) образуется по донорно-акцепторному механизму:
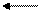
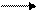
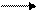

 NH3 + HOH NH3∙HOH NH4 + + OH - t NH3 + H2O
NH3 + HOH NH3∙HOH NH4 + + OH - t NH3 + H2O
В водных растворах NH3 существует виде трехмерной структуры, то есть молекула аммиака окружена водой:
 H
H


 H-O: H N: H O:
H-O: H N: H O:


|
|
Дата добавления: 2015-05-09; Просмотров: 446; Нарушение авторских прав?; Мы поможем в написании вашей работы!