
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Цикл Карно
|
|
|
|
Квазистатический – процесс, в ходе которого система все время остается в состоянии равновесия.
 |
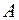 | 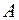 | 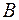 |
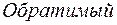 |  |



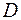 |

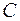 |


 Р Р
Р Р


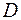 |  | ||

 |


V V

Садди Карно 1796-1832 Французский физик.
 |
 |
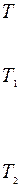 | |||
 | |||
 |

 | 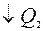 | ||
 |
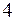 | 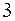 |
 |
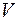 | 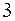 |
 |
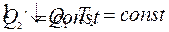 |  | ||||||||
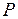 | 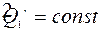 | 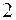 | |||||||
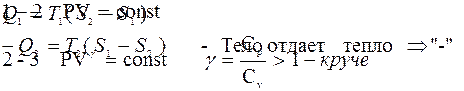
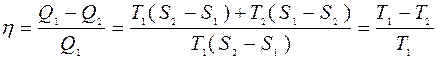
η-всех обратимых систем, работающих в идентичных условиях одинаков и определяется только температурами нагревателя и холодильника.
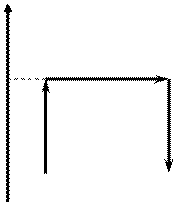
Тепловая машина.
Нагреватель==рабочее тело--холодильник
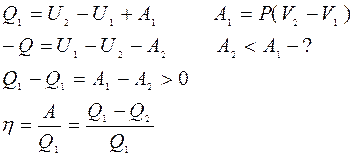 |
Нельзя ли построить периодически действующую тепловую машину без холодильника. Q2=0 => такая машина превращала бы в работу всю теплоту, заимствованную от нагревания.
Закон сохранения энергии разрешает => тепло из океана… и вечный двигатель => Вильтгельм Оствальд (1853-1932 гг.) – перпетуум мобиле 2-го рода.
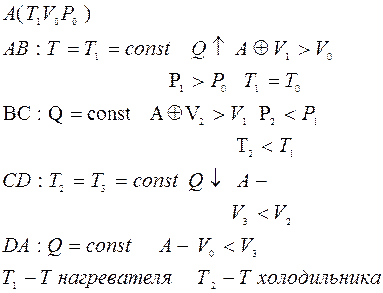 |
Возможность совершения работы тепловыми двигателями обусловлена переходом тепла от тела более нагретому к телу менее нагретому.
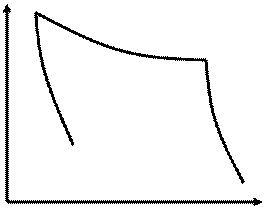
Цикл Карно.
Тепловая машина: нагреватель + рабочее тело + холодильник
· Роль рабочего тела.
· При теплообмене работы не совершается => вреден.
· Принцип В. Томсона (ещё не Л. Кельвин)
Невозможно осуществить циклический процесс, единственным результатом которого было бы превращение в работу теплоты отнятой у какого-либо тела, без каких-либо изменений в окружающих телах.
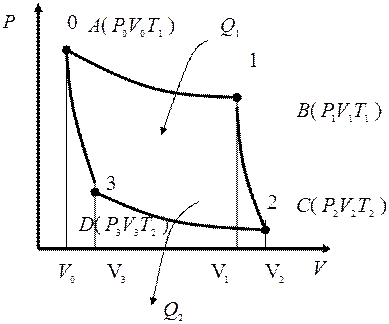 Рабочее тело – идеальный газ.
Рабочее тело – идеальный газ.
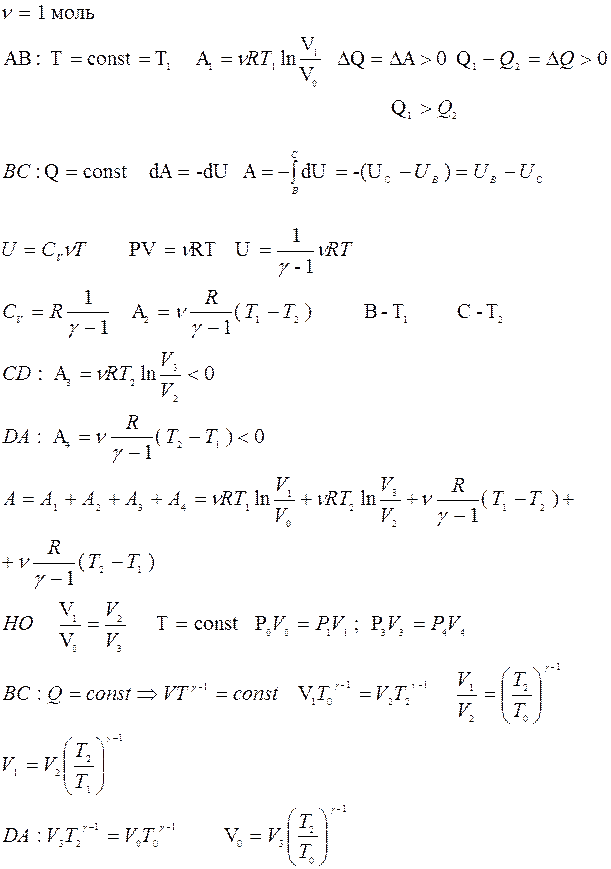
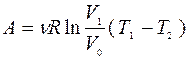 |
 |

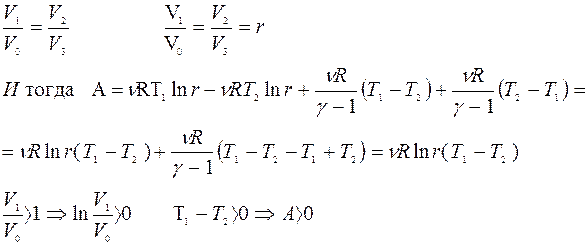 |
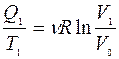 |
Получено от нагревателя: Q1 =?
 |
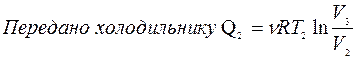 | 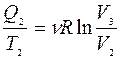 |
 |
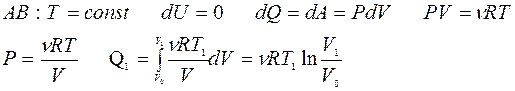
 |



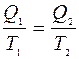 |
Преобразовано в работу
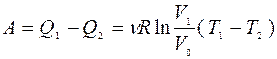
 |
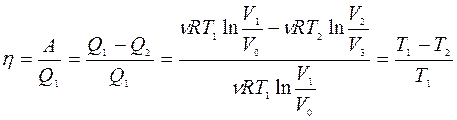 |
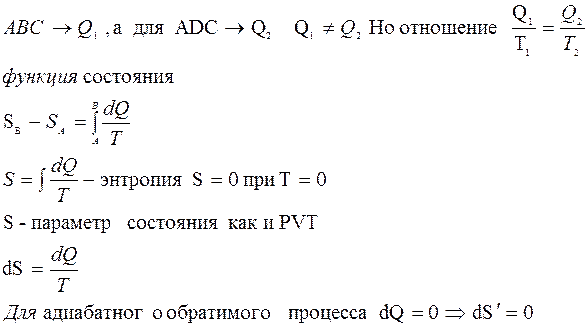 |
Энтропия.
В замкнутой системе при протекании любого обратимого процесса энтропия остается неизменной
S = constdS = 0
При протекании в замкнутой термодинамической системе необратимого процесса, энтропия системы возрастает, достигая своего максимума в состоянии равновесия системы.
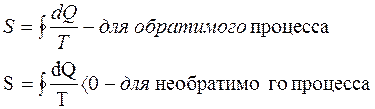 |
Если S = Smax то какие либо изменения в системе без внешнего воздействия невозможны.
Энтропия -мера отклонения реального процесса от идеального
сумма приведенных теплот системы является функцией состояния системы и остается постоянной при обратимых процессах и возрастает в необратимых процессах.
I-начало:
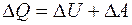
Закон сохранения энергии.
II-начало:
Энтропия замкнутой системы может только возрастать (не убывать).
· Устанавливает наличие в природе фундаментальной асимметрии – однонаправленность всех самопроизвольно происходящих в природе процессов.
· Количество энергии в замкнутых системах сохраняется, но распределение энергии меняется необратимым образом.
III-начало:
При Т→0 S→0, т.е. невозможно охладить вещество до температуры абсолютного нуля.
Отличие энергии от внутренней энергии.
U-S
1) общее-функции состояния.
2) U=const для замкнутой системы.
3) энтропия, однажды созданная, не может уменьшиться.
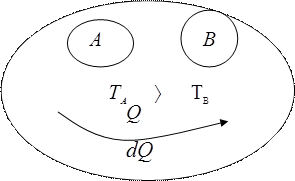
Увеличение энтропии при теплопередаче
 |
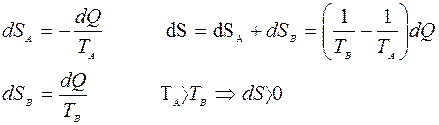 |
Необратимые процессы в замкнутой системе всегда сопровождаются возрастанием энтропии.
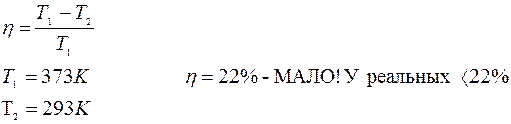 |
Тепло, заимствованное у источника, не может быть целиком преобразовано в работу.
Различные формулировки II начала термодинамики.
1. Вильям Томсон ↔ лорд Кельвин 1851.
«Невозможен круговой процесс единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара.»
Невозможен круговой процесс, единственным
результатом которого было бы производство работы
за счет уменьшения внутренней энергии теплового резервуара
2. Клаузиус (1822 – 1888) в 1850
“ Теплота не может самопроизвольно переходить от тела менее нагретого к телу более нагретому.”
Вообще “она” возможна. Но она невозможна при условии, что во всех остальных телах не произошло никаких изменений.
Холодильник, но процесс не самопроизвольный, а сопровождается работой электрического мотора.
3. т. Нернста: энтропия любого тела стремится к нулю при Т → 0
lim S = 0
Т → 0
Направление термодинамических процессов в изолированной системе → к состояниям, вероятность которых максимальна:
· Теплопередача => выравнивание температур.
· Диффузия => однородный газ не может собраться в одной половинке сосуда.
·
Cвязь энтропии с вероятностью.
S = k ln ω
Всякий процесс в природе протекает так, что система переходит в состояние, вероятность которого больше.
!Если система находится в состоянии с данной энтропией, то с подавляющей вероятностью следует ожидать, что она перейдет в состояние с большей энтропией, т. е. что наиболее вероятным изменением энтропии является ее возрастание. Но возможны и процессы с уменьшением энтропии – флуктуации ω в среднем росте.
Статистический вес - число различных микросостояний, посредством которых осуществляется данное макросостояние.
ω; Все макросостояния равновероятны => вероятность макросостояния пропорциональна его статистическому весу.
S = k lnω – энтропия – характеризует вероятность состояния термодинамической системы.

Необратимый - процесс, обратный к которому маловероятен - диффузия газ сосредоточился в половине сосуда.
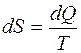 |
В случае обратимого процесса в неизолированной системе энтропия может как возрастать, так и убывать
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 461; Нарушение авторских прав?; Мы поможем в написании вашей работы!