
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплоемкость газов
|
|
|
|
ЗАДАЧИ
2.1 Процентный массовый состав дымового газа следующий: 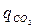 = 15 %,
= 15 %, 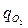 = 6 %;
= 6 %; 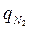 = 79 %. Найти молекулярный вес газа, газовую постоянную, плотность и удельный объем при нормальных условиях. Найти парциальное давление каждого газа, входящего в смесь, считая давление смеси р = 740 мм рт.ст.
= 79 %. Найти молекулярный вес газа, газовую постоянную, плотность и удельный объем при нормальных условиях. Найти парциальное давление каждого газа, входящего в смесь, считая давление смеси р = 740 мм рт.ст.
Ответ: mсм= 29,8;vсм = 0.751 м3/кг; r = 1,33 кг/м3;
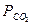 = 9997,5 Па
= 9997,5 Па
2.2 Найти давление смеси по манометру, если масса ее М = 20 кг; V = 4 м3; t = 100 °С, причем состав смеси по объему 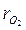 = 0,4;
= 0,4;  = 0,6.
= 0,6.
Ответ: 0,297 Мпа.
2.3 Анализом определен объемный состав газовой смеси: 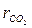 =0,12;
=0,12; 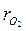 =0,05;
=0,05; 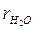 = 0,03;
= 0,03; 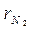 = 0,80. Определить плотность и удельный объем смеси при нормальных условиях, молекулярный вес, газовую постоянную и относительный массовый состав ее.
= 0,80. Определить плотность и удельный объем смеси при нормальных условиях, молекулярный вес, газовую постоянную и относительный массовый состав ее.
Ответ: mсм = 29,8; vсм = 0.752 м3/кг; rсм = 1,33 кг/м3; 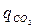 = 0.177 и т.д.
= 0.177 и т.д.
2.4 Смесь состоит из 50 кг дымовых газов, массовый состав которых: СО2= 14 %; О2 = 6 %; Н2О = 5 %; N2 = 75 % и 75 кг воздуха. Определить массовый и объемный составы смеси, если массовый состав воздуха: О2 = 23,2 %; N2 = 76,8 %.
Ответ: 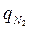 = 0,761 и т.д.;
= 0,761 и т.д.; 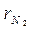 = 0,78 и т.д.
= 0,78 и т.д.
2.5 Состав горючего газа по массе: Н2 = 1,5 %; СО = 28 %;СО2 = 10,0 %; N2 = 60,5 %. Определить объемный состав, плотность и удельный объем при Р = 0,2 МПа и t = 100 oС, а также количество киломолей в 1 т смеси. Ответ: 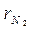 = 0,525 и т.д.;
= 0,525 и т.д.;
vсм = 0.655 м3/кг;rсм = 1,53 кг/м3; Ксм= 41,4 кмоля.
2.6 До какого давления по манометру нужно довести смесь газов, состоящую из 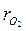 = 0,14;
= 0,14; 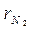 = 0,25 и
= 0,25 и 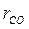 = 0,61, чтобы парциальное давление в ней составляло
= 0,61, чтобы парциальное давление в ней составляло 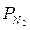 = 0,12 МПа? Какое давление при этом будет иметь СО? Принять В = 780 мм рт. ст.
= 0,12 МПа? Какое давление при этом будет иметь СО? Принять В = 780 мм рт. ст.
Ответ: 0,73 МПа, 0,513 МПа.
2.7. Для светильного газа анализ дал следующий состав в объемных долях: 50 % Н2; 30 % СН4; 15 % СО; 3 % CO2; 2 % N2. Чему равны газовая постоянная и средний молекулярный вес этого газа? Каков состав в весовых долях и чему равна плотность газа при 25оС и давлении 750 мм рт.ст. Ответ: Rсм= 0,698 кДж/кг К; rсм = 0,461 кг/м3.
2.8 Определить объем 3 кг смеси, относительный массовый состав которой следующий: 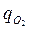 = 0,4;
= 0,4; 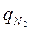 =0,2;
=0,2; 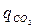 = 0,4. Температура смеси t = 50oС, давление по манометру Р = 600 мм рт.ст. Давление атмосферы нормальное.
= 0,4. Температура смеси t = 50oС, давление по манометру Р = 600 мм рт.ст. Давление атмосферы нормальное.
Ответ: V = 2,38 м3.
2.9 Определить массу 4 м3 смеси, относительный объемный состав которой следующий: 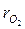 = 0,4;
= 0,4; 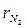 = 0,2;
= 0,2;  = 0,4. Температура смеси t = 50 oС; давление по манометру Р = 0,04 МПа В = 700 мм рт. ст. (93,325 кПа). Ответ: 7,07 кг.
= 0,4. Температура смеси t = 50 oС; давление по манометру Р = 0,04 МПа В = 700 мм рт. ст. (93,325 кПа). Ответ: 7,07 кг.
2.10 Дымовые газы поступают в первый ход котла при t1 = 1200 oС, а выходят при t2 = 800 oС. Состав газов по объему:  = 12 %;
= 12 %; 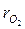 = 5 %;
= 5 %;  = 8 %, остальное азот. Вычислить количество теплоты, теряемое 1 м3 (при нормальных условиях) газовой смеси, считая зависимость
= 8 %, остальное азот. Вычислить количество теплоты, теряемое 1 м3 (при нормальных условиях) газовой смеси, считая зависимость 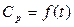 нелинейной.
нелинейной.
Ответ: 160 ккал/м3 (670,4 кДж/м3),
Теплоемкостью называют количество тепла, которое необходимо сообщить телу (газу), чтобы повысить температуру какой-либо количественной единицы его на I ОC.
В зависимости от выбранной количественной единицы различают весовую теплоемкость (С - кДж/кг К), объемную теплоемкость (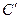 - кДж/нм3 К) и мольную теплоемкость (mС - кДж/моль К).
- кДж/нм3 К) и мольную теплоемкость (mС - кДж/моль К).
Для определения значений этих теплоемкостей достаточно знать значение одной какой-либо из них. Удобнее всего иметь значение мольной теплоемкости.
Весовая теплоемкость тогда определяется из выражения
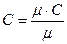 , кДж/кг К, (3.1)
, кДж/кг К, (3.1)
а объемная теплоемкость получается равной
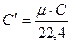 , кД./нм3К. (3.2)
, кД./нм3К. (3.2)
Объемная и весовая теплоемкости связаны между собой следующей зависимостью.
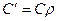 . кДж/нм3 К, (3.3)
. кДж/нм3 К, (3.3)
где r - плотность газа при нормальных условиях.
Теплоемкость газа зависит от его температуры. По этому признаку различают среднюю и истинную теплоемкость.
Если q - количество тепла, сообщаемое единице количества газа (или отнимаемое от него) при изменении температуры газа от t1 до t2 (или, что то же, от T1 до Т2), то величина
 , (3.4)
, (3.4)
представляет собой среднюю теплоемкость в пределах от t1 до t2.Предел этого отношения, когда разность температур стремится к нулю, называется истинной теплоемкостью. Аналитически последняя определяется как,
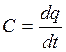 .
.
Теплоемкость идеальных газов зависит не только от их температуры, но и от их атомности и характера процесса. Теплоемкость реальных газов зависит от их природных свойств, характера процесса, температуры и давления.
Для газов особо важное значение имеют следующие два случая нагрева (охлаждения):
1) изменение состояния при постоянном объеме;
2) изменение состояния при постоянном давлении;
Обоим этим случаям соответствуют различные значения теплоемкостей.
Таким образом, различают истинную и среднюю теплоемкость:
а) весовую - при постоянном объеме (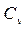 и
и 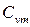 ) и постоянном давлении (Ср и Сpm);
) и постоянном давлении (Ср и Сpm);
б) объемную - при постоянном объеме (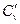 и
и  ) и постоянном давлении (
) и постоянном давлении (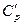 и
и  );
);
в) мольную - при постоянном объеме (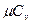 и
и 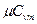 ) и постоянном давлении (
) и постоянном давлении (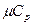 и
и 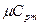 ).
).
Между мольными теплоемкостями при постоянном давлении и при постоянном объеме существует зависимость:

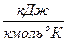 . (3.5)
. (3.5)
Отношение теплоемкостей 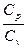 , обозначаемое буквой К, называется показателем адиабаты:
, обозначаемое буквой К, называется показателем адиабаты:
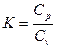 . (3.6)
. (3.6)
Этот показатель играет в термодинамике большую роль. Показатель адиабаты зависит от атомности газа. Для одноатомных газов К = 1,6, двухатомных - К = 1,4, трехатомных - К = 1,3.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1623; Нарушение авторских прав?; Мы поможем в написании вашей работы!