
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тобто наступає рівновага
|
|
|
|
Визначення умов, при яких можливе протікання процесу і
ЗАГАЛЬНІ ПРИНЦИПИ АНАЛІЗУ І РОЗРАХУНКУ ХТП
При дослідженні або розрахунку хіміко-технологічних процесів одною з основних задач є визначення швидкості переносу субстанції (маси, тепла, кількості руху) із однієї точки системи в другу, а в гетерогенних системах – із однієї фази в другу. Існує загальна схема аналізу і розрахунку різних
процесів, яка включає декілька станів.
кінцевого стану системи, при якому процес припиняється,
Умовою протікання гідромеханічних процесів в системі є нерівномірний розподіл в ній тиску, теплових процесів – нерівномірний розподіл температур, масообмінних процесів – нерівність хімічних потенціалів окремих компонентів в різних фазах.
Якщо в системі dP=0, то наступає механічна рівновага, якщо dТ=0,
то підтримується теплова рівновага, якщо dµі=0, то відсутній перенос
відповідного компонента.
Хімічний потенціал і-го компонента µі – це приріст внутрішньої
енергії системі при додаванні до неї 1 моля і-го компонента (при безкінечному числі молей компонентів в системі).
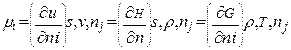
Для суміші ідеальних газів 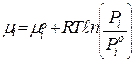 (1)
(1)
де µі - значення хімічного потенціалу при стандартному тиску
(Ріо=0,1 МПа);
Рі - парціальний тиск і-го компонента в суміші.
Для ідеальних розчинів µі=φіо + Rтℓnxі (2)
де xі - мольна доля і-го компонента в розчині.
При рівновазі між газом і розчином

або 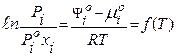



 При даній температурі Т=const
При даній температурі Т=const


 - закон Генрі.
- закон Генрі.
Тут Н - константа Генрі
xi - мольна доля і-го компонента в розчині;
Ріх - парціальний тиск і-го компонента в газовій фазі при
рівновазі в системі.
|
По закону Дальтона,
де Р - загальний тиск в системі;
|
Тоді рівняння рівноваги в вигляді,
де 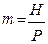 - коефіцієнт розподілу і-го компонент а між фазами.
- коефіцієнт розподілу і-го компонент а між фазами.
Якщо уі > уі*, то компонент переходить із газу в розчин.
Якщо уі < уі*, то компонент переходить із розчину в газ
Якщо уі > уі*, то система перебуває в рівновазі.
При протіканні в системі оборотної реакції рівновага наступає, коли співвідношення концентрацій компонентів суміші буде відповідати константі рівноваги.
Наприклад, при досягненні рівноваги реакції

 СН4+Н2О СО+3Н2
СН4+Н2О СО+3Н2

де К – f (т) - константа рівноваги реакції.
Знаючи К і склад початкової суміші, можна визначити максимальну ступінь перетворення початкової речи винив кінцеві продукти

або максимальний вихід кінцевого продукту
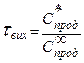 ,
,
де 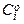 - початкова концентрація речовини, що вступає в реакцію;
- початкова концентрація речовини, що вступає в реакцію;
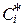 - концентрація цієї речовини після закінчення реакції
- концентрація цієї речовини після закінчення реакції
(при досягненні рівноваги);
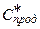 - концентрація продукту в суміші після досягнення рівноваги;
- концентрація продукту в суміші після досягнення рівноваги;
 - концентрація продукту в суміші при умові повного
- концентрація продукту в суміші при умові повного
перетворення початкової речовини.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 383; Нарушение авторских прав?; Мы поможем в написании вашей работы!