
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химическое равновесие
|
|
|
|
Все химические реакции можно разделить на две группы: необратимые и обратимые реакции. Необратимые реакции протекают до конца (до полного расхода одного из реагентов), а в обратимых ни одно из реагирующих веществ не расходуется полностью, потому что обратимая реакция может протекать как в прямом, так и в обратном направлении.
Пример необратимой реакции:
Zn + 4HNO3 → Zn(NO3)2 + 2NO2↑ + 2H2O
Пример обратимой реакции:
H2 + I2  2HI
2HI
Вначале скорость прямой реакции v пр велика, а скорость обратной реакции v об равна нулю (рисунок 2.3).
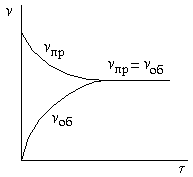
| Рисунок 2.3 – Зависимость скоростей прямой и обратной реакций от времени τ. При равенстве этих скоростей наступает химическое равновесие. |
По мере протекания реакции исходные вещества расходуются, и их концентрации падают. Одновременно появляются продукты реакции, их концентрации возрастают. Вследствие этого начинает идти обратная реакция, причем ее скорость постепенно увеличивается. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает химическое равновесие. Оно является динамическим, т.к., хотя концентрации веществ в системе остаются постоянными, реакция продолжает протекать как в прямом, так и в обратном направлении.
При равенстве v пр и v об можно приравнять их выражения согласно закону действия масс *. Например, для обратимого взаимодействия водорода с иодом:
k пр·[H2]·[I2]= k об·[HI]2 или

Отношение констант скорости прямой и обратной реакций (K) называется константой равновесия. При постоянной температуре константа равновесия представляет собой постоянную величину, показывающую то соотношение между концентрациями продуктов и исходных веществ, которое устанавливается при равновесии. Величина K зависит от природы реагирующих веществ и от температуры.
Система находится в состоянии равновесия до тех пор, пока внешние условия сохраняются постоянными. При увеличении концентрации какого-либо из веществ, участвующих в реакции, равновесие смещается в сторону расхода этого вещества; при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества.
Когда в реакции участвуют газы, равновесие может нарушаться при изменении давления:
2NO + O2  2NO2
2NO2
v пр= k пр·[NO]2·[O2]; v об= k обр·[NO2]2
При увеличении давления, например, в 2 раза концентрация каждого газа возрастет в 2 раза, и новые скорости реакций станут равными v пр´ и v об´:
v пр´=8 v пр; v об´=4 v об
Неодинаковое изменение скоростей прямой и обратной реакций связано с тем, что в левой и правой частях уравнения реакции различно число молекул газов. В связи с этим равновесие при возрастании давления сдвигается в сторону уменьшения числа молекул газов, т.е. в сторону понижения давления.
Влияние температуры на константу равновесия. Тепловой эффект реакции можно рассматривать как разность энергий активации прямой и обратной реакций: Δ H = E a(пр) – E a(об). Для эндотермических реакций Δ H >0; для экзотермических реакций Δ H <0. Согласно уравнению Аррениуса *, зависимость константы равновесия от температуры можно выразить следующим образом:

Из уравнения, связывающего константу равновесия с тепловым эффектом Δ H, следует, что при возрастании температуры равновесиеэндотермической реакции смещается вправо, а экзотермических реакций – влево. Оказывается также, что катализатор * не влияет на константу равновесия, так как он снижает энергию активации * прямой и обратной реакций на одну и ту же величину.
Закономерности, которые проявляются в рассмотренных примерах, представляют собою частные случаи общего принципа, определяющего влияние различных факторов на равновесие системы. Это принцип Ле-Шателье: если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие смещается в таком направлении, что оказанное воздействие уменьшится.
21. Условия смещения химического равновесия (влияние концентрации, температуры, давления). Принцип Ле Шателье.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 440; Нарушение авторских прав?; Мы поможем в написании вашей работы!