
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние температуры
|
|
|
|
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
При повышении температуры на каждые 10о скорость большинства реакций увеличивается в 2-4 раза.
Математически эта зависимость выражается соотношением

vt 2 = vt 1 γ,
где vt 1, vt 2 - скорости реакции соответственно при начальной (t 1) и конечной (t 2) температурах, а γ - температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость реакции с повышением температуры реагирующих веществ на 10°.
Правило Вант-Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции. Температура влияет на скорость химической реакции, увеличивая константу скорости.
19. Понятие о катализаторах, катализе. Энергия активации.
е соединения катализатора с реагирующими веществами. Проходя через ряд стадий (подвод реагентов в зону реакции, адсорбция на поверхности катализатора, собственно химическая реакция, десорбция), в которыхучаствуют и промежуточные соединения, реакция заканчивается образованием конечных продуктов, а катализатор – не расходуется.
Гетерогенный катализ в промышленности применяется при получении аммиака, азотной и серной кислот, водорода и пр. К наиболее распространенным катализаторам относятся: Pt, Ni, Pd, CuO, V2O5, Al2O3, SiO2 и др. Применение каталитических процессов обеспечивает экономию сырья и энергии, а также решает экологические задачи. Например, катализаторы применяют для доокисления токсичных выхлопных газов в двигателях внутреннего сгорания до нетоксичных компонентов:
CnHm + qO2 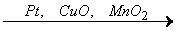 nCО2 + m/2Н2О,
nCО2 + m/2Н2О,
2NO + 2CO  N2 +2CO2 + 690 кДж (в качестве катализатора используется металлическая вата из нержавеющей стали или сплавы никеля).
N2 +2CO2 + 690 кДж (в качестве катализатора используется металлическая вата из нержавеющей стали или сплавы никеля).
3.2.6. Необратимые и обратимые реакции, химическое равновесие
Все химические реакции делятся на две группы: необратимые и обратимые.
Необратимые реакции протекают в одном направлении, до полного израсходования одного из реагирующих веществ, обязательное условие их протекания – удаление продуктов реакции из сферы реакции (в виде газа, нерастворимого соединения или слабого электролита).
Пример:
Zn + 4HNO3 = Zn(NO3)2 + 2NO2↑ + 2H2O.
Обратимые реакции протекают в двух взаимно противоположных направлениях, реакция не идет до конца, т. е. ни одно из реагирующих веществ не расходуется полностью, реакция идет до определенного предела, называемого химическим равновесием.
Рассмотрим обратимый процесс: H2 + J2 ↔ 2HJ.
В начальный момент времени (  ) концентрации исходных веществ равны:
) концентрации исходных веществ равны:  , а концентрация продуктов реакции отсутствовала:
, а концентрация продуктов реакции отсутствовала:  = 0. При этих условиях реакция протекает только в прямом направлении, кинетическое уравнение имеет вид:
= 0. При этих условиях реакция протекает только в прямом направлении, кинетическое уравнение имеет вид:
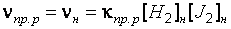 . (41)
. (41)
Скорость обратной реакции в начальный момент времени равна нулю:
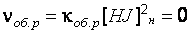 . (42)
. (42)
В ходе прямой реакции концентрации водорода и иода непрерывно уменьшаются, в соответствии с этим пропорционально снижается скорость прямого процесса. Одновременно с этим нарастает концентрация продукта реакции HJ и в момент времени 
 ≠ 0. Появляются условия, определяющие протекание обратной реакции, кинетическое уравнение обратного процесса имеет вид:
≠ 0. Появляются условия, определяющие протекание обратной реакции, кинетическое уравнение обратного процесса имеет вид:
 . (43)
. (43)
По мере нарастания концентрации иодоводорода HJ увеличивается скорость обратной реакции, в момент времени 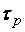 , когда скорости прямой и обратной реакции выравниваются:
, когда скорости прямой и обратной реакции выравниваются:
 , (44)
, (44)
наступает динамическое химическое равновесие системы.
Химическое равновесие – это такое состояние системы, при котором скорости прямого и обратного процессов равны, а концентрации всех веществ, участвующих в процессе, перестают изменяться и называются равновесными.
Состояние равновесия характеризует тот предел, к которому в данных условиях обратимая реакция протекает самопроизвольно,  → 0.
→ 0.
В формуле (44) выразим скорости реакций через равновесные концентрации реагирующих веществ:
 . (45)
. (45)
Перенесем константы в одну сторону уравнения, а равновесные концентрации – в другую:
 . (46)
. (46)
Отношение констант скоростей прямого и обратного процессов тоже представляет собой постоянную величину, которая называется константой равновесия данного равновесного процесса 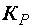 . Для равновесного процесса, протекающего при постоянной температуре, в общем случае: mA + nB ↔ pC + qD, константа равновесия выразится уравнением:
. Для равновесного процесса, протекающего при постоянной температуре, в общем случае: mA + nB ↔ pC + qD, константа равновесия выразится уравнением:
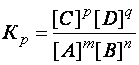 , (47)
, (47)
где  – равновесные концентрации продуктов реакции;
– равновесные концентрации продуктов реакции;  – равновесные концентрации исходных веществ,
– равновесные концентрации исходных веществ,  – стехиометрические коэффициенты в уравнении реакции.
– стехиометрические коэффициенты в уравнении реакции.
Константа равновесия является количественной характеристикой равновесного процесса:
– для необратимых реакций, прошедших до конца, 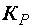 →
→  , так как концентрация продуктов реакции значительно больше концентрации исходных веществ;
, так как концентрация продуктов реакции значительно больше концентрации исходных веществ;
– при полном отсутствии химического взаимодействия,  , так как концентрация исходных веществ значительно превосходит концентрацию продуктов реакции.
, так как концентрация исходных веществ значительно превосходит концентрацию продуктов реакции.
В случае гетерогенных равновесных процессов в выражение константы равновесия входят только концентрации тех веществ, которые находятся в газовой или жидкой фазе.
Пример: CO2(Г) + С(К) ↔ 2СО(Г),
 . (48)
. (48)
Константа равновесия реакции связана с изменением энергии Гиббса процесса зависимостью:
 . (49)
. (49)
Уравнение (49) справедливо для любой температуры, но чаще применяется для стандартных условий: 25 °С (298 К). При подстановке значения газовой постоянной (  = 8,314 Дж/ моль∙К) и стандартной температуры уравнение (49) примет вид:
= 8,314 Дж/ моль∙К) и стандартной температуры уравнение (49) примет вид:
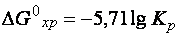 . (50)
. (50)
Это уравнение позволяет, зная значение  , вычислять константу равновесия и, наоборот, по экспериментально найденному значению
, вычислять константу равновесия и, наоборот, по экспериментально найденному значению 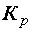 определять
определять  .
.
3.2.7. Смещение химического равновесия, принцип Ле Шателье
Состояние химического равновесия зависит от ряда факторов: концентрации реагирующих веществ, температуры, давления в системе. Если условия изменяются, система выходит из состояния равновесия, при этом скорости прямой и обратной реакций изменяются не пропорционально. Через некоторое время равновесие устанавливается при новых внешних условиях.
Переход из одного равновесного состояния в другое, отвечающее новым внешним условиям, называется сдвигом или смещением химического равновесия.
В 1884 г. Ле Шателье (Франция) сформулировал принцип, определяющий влияние различных факторов на равновесные системы.
Если на систему, находящуюся в равновесии, оказать какое-либо воздействие (изменить концентрацию веществ, температуру или давление), то в результате протекающих в ней процессов равновесие сместится в том направлении, что оказанное воздействие уменьшится.
Рассмотрим частные случаи нарушения химического равновесия.
1. Нарушение равновесия вследствие изменения концентрации какого-либо из веществ, участвующих в равновесном процессе.
При увеличении концентрации какого-либо из веществ в равновесном процессе, равновесие смещается в сторону реакции, вызывающей расход этого вещества; при уменьшении концентрации какого-либо из веществ – в сторону образования этого вещества.
Пример, имеем обратимый равновесный процесс:
3KSCN + FeCl3 ↔ Fe(SCN)3 + 3KCl,
в ходе реакции образуется слабо диссоциирующий тиоционат железа Fe(SCN)3 буро-красной окраски.
Добавим в систему избыток FeCl3. Согласно закону действия масс увеличение концентрации одного из исходных веществ (↑[FeCl3]) приводит к повышению скорости прямой реакции (↑  ), а скорость обратной реакции на начальном этапе останется не изменой (
), а скорость обратной реакции на начальном этапе останется не изменой (  ).
).
В результате – концентрации исходных веществ будут снижаться, а продуктов реакции – возрастать. Окраска раствора станет более интенсивной. Однако, через некоторое время, в результате повышения концентрации продуктов реакции, увеличится скорость обратной реакции, и равновесие установится при новых условиях.
При введении в исходную равновесную систему дополнительно продукта реакции KCl, окраска раствора ослабнет, ввиду ускорения обратного процесса, так как именно обратная реакция противодействует изменению внешнего фактора и вызывает расход продукта реакцииKCl.
2. Нарушение равновесия вследствие изменения температуры.
При повышении температуры равновесие смещается в сторону реакции, поглощающей тепло, т. е. эндотермического процесса, а при понижении – в направлении экзотермической реакции.
Пример, синтез аммиака представляет собой экзотермическую реакцию:
|
При повышении температуры равновесие в системе сместится в сторону поглощения тепла, т. е. в сторону обратной реакции (эндотермического процесса) разложения аммиака. При понижении температуры система сама будет стремиться дополнительно выделить тепло, т. е. увеличится скорость прямого экзотермического процесса, равновесие сместится в сторону прямой реакции образования аммиака.
3. Нарушение равновесия вследствие изменения давления (объема газообразной равновесной системы).
При увеличении давления в газообразной равновесной системе путем сжатия (уменьшение объема газов) равновесие сдвигается в сторону реакции, приводящей к уменьшению числа молей газа, так как этот процесс понижает давление в системе, противодействуя внешнему фактору. При уменьшении давления (увеличении объема) газообразной равновесной системы равновесие смещается в сторону образования большего числа молей газа, т. е. в сторону увеличения давления.
Пример, в реакции синтеза аммиака: N2 + 3H2 ↔ 2NH3, смесь газов (N2, H2, NH3) находится в химическом равновесии при определенной температуре и давлении, причем в исходных веществах – 4 моля газа, продуктах реакции – 2 моля. При увеличении давления (равновесная система сжимается) увеличится скорость прямой реакции, приводящей к образованию меньшего числа молей газа и понижению давления, кроме того, меньший объем займет меньшее число молей газа. При уменьшении давления (увеличении объема равновесной системы) равновесие сместится в сторону обратной реакции, приводящей к образованию большего числа молей газа и повышению давления.
В том случае, когда обратимый равновесный процесс протекает без изменения числа молей газов: H2 + J2 ↔ 2HJ, равновесие не нарушается при сжатии или расширении системы.
| ОБЩАЯ ХИМИЯ |
| СТРОЕНИЕ ВЕЩЕСТВА |
| КАТАЛИЗАТОРЫ |
| Вещества, которые ускоряют химические реакции, но сами при этом не расходуются, называются катализаторами. Например, разложение бертолетовой соли и перокси-да водорода ускоряется в присутствии оксида марганца (IV). Различают гомогенный и гетерогенный катализ. В первом случае катализатор и реагирующие вещества находятся в одинаковом агрегатном состоянии (образуют одну фазу), во втором — в разных агрегатных состояниях (фаза). Для объяснения каталитического действия при гомогенном катализе выдвинута гипотеза об образовании промежуточных продуктов с участием катализатора. А + В --> АВ — некаталитическая реакция. А + К --> АК АК + В --> АВ + К А + К + В = АВ + К- каталитическая реакция. Ускорение реакции достигается за счет того, что промежуточные продукты имеют более низкую энергию активации, чем продукты некаталитической реакции. При гетерогенном катализе согласно адсорбционной теории катализа реагирующие вещества адсорбируются на поверхности катализатора, в результате чего происходит их активация. Активация молекул является результатом ослабления в них химических связей, некоторой деформации, увеличения расстояния между атомами, а иногда и диссоциации молекул на атомы под действием так называемых активных центров поверхности гетерогенного катализатора. |
20. Необратимые и обратимые химические реакции. Химическое равновесие.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 593; Нарушение авторских прав?; Мы поможем в написании вашей работы!
 = –92,4 кДж.
Эндотермич.р
= –92,4 кДж.
Эндотермич.р