
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронные формулы, обозначения и русские наименования атомов химических элементов. 2 страница
|
|
|
|
7 период:
| Fr | франций | Fr - [Rn] 7 s 1 | Fr - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 7 s 1 | |
| Ra | радий | Ra - [Rn] 7 s 2 | Ra - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 7 s 2 | |
| Ac | актиний | Ac - [Rn] 6 d 1 7 s 2 | Ac - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 6 d 1 7 s 2 | |
| Th | торий | Th - [Rn] 6 d 2 7 s 2 | Th - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 6 d 2 7 s 2 | |
| Pa | протактиний | Pa - [Rn] 5 f 2 6 d 1 7 s 2 | Pa - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 2 6 d 1 7 s 2 | |
| U | уран | U - [Rn] 5 f 3 6 d 1 7 s 2 | U - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 3 6 d 1 7 s 2 | |
| Np | нептуний | Np - [Rn] 5 f 5 7 s 2 | Np - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 5 7 s 2 | |
| Pu | плутоний | Pu - [Rn] 5 f 6 7 s 2 | Pu - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 6 7 s 2 | |
| Am | америций | Am - [Rn] 5 f 7 7 s 2 | Am - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 7 7 s 2 | |
| Cm | кюрий | Cm - [Rn] 5 f 7 6 d 1 7 s 2 | Cm - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 7 6 d 1 7 s 2 | |
| Bk | берклий | Bk - [Rn] 5 f 9 7 s 2 | Bk - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 9 7 s 2 | |
| Cf | калифорний | Cf - [Rn] 5 f 10 7 s 2 | Cf - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 10 7 s 2 | |
| Es | эйнштейний | Es - [Rn] 5 f 11 7 s 2 | Es - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 11 7 s 2 | |
| Fm | фермий | Fm - [Rn] 5 f 12 7 s 2 | Fm - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 12 7 s 2 | |
| Md | менделеевий | Md - [Rn] 5 f 13 7 s 2 | Md - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 13 7 s 2 | |
| No | нобелий | No - [Rn] 5 f 14 7 s 2 | No - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 14 7 s 2 | |
| Lr | лоуренсий | Lr - [Rn] 5 f 14 6 d 1 7 s 2 | Lr - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 14 6 d 1 7 s 2 | |
| Rf | резерфордий | Rf - [Rn] 5 f 14 6 d 2 7 s 2 | Rf - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 14 6 d 2 7 s 2 | |
| Db | дубний | Db - [Rn] 5 f 14 6 d 3 7 s 2 | Db - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 14 6 d 3 7 s 2 | |
| Sg | сиборгий | Sg - [Rn] 5 f 14 6 d 4 7 s 2 | Sg - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 14 6 d 4 7 s 2 | |
| Bh | борий | Bh - [Rn] 5 f 14 6 d 5 7 s 2 | Bh - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 14 6 d 5 7 s 2 | |
| Hs | хассий | Hs - [Rn] 5 f 14 6 d 6 7 s 2 | Hs - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 14 6 d 6 7 s 2 | |
| Mt | мейтнерий | Mt - [Rn] 5 f 14 6 d 7 7 s 2 | Mt - 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 6 4 f 14 5 d 10 6 s 2 6 p 6 5 f 14 6 d 7 7 s 2 |
В 1925 году швейцарский физик В. Паули (V. Pauli) установил закон, называемый принципом Паули. Он гласит: в любой квантово-механической системе (в том числе в атоме) не может быть двух электронов, находящихся в одинаковых стационарных состояниях, определяемых одинаковым набором четырех квантовых чисел: главного n, орбитального l, магнитного m и спинового ms.
Пользуясь принципом Паули, можно найти максимальное число электронов в атоме, имеющих заданные значения трех (n, l, m), двух (n, l) и одного (n) квантовых чисел. Найдем максимальное число электронов Z (n, l, m), находящихся в состояниях, определяемых набором трех квантовых чисел (n, l, m), т.е. отличающихся лишь ориентацией спинов электронов. Так как число ms может принимать значения 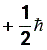 и
и  , то, очевидно, имеем
, то, очевидно, имеем

Вычислим далее максимальное число электронов Z (n, l), находящихся в состояниях, определяемых двумя квантовыми числами: n и l. Так как при заданном числовом значении l вектор момента импульса 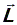 может иметь (2 l + 1) различных ориентаций в пространстве, то число таких электронов равно
может иметь (2 l + 1) различных ориентаций в пространстве, то число таких электронов равно
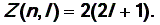
Значения максимального числа электронов Z (n, l) для различных значений квантового числа l приведены в таблице 1.
Найдем максимальное число Z (n) электронов, находящихся в состояниях, определяемых заданным значением главного квантового числа n. Так как число l при заданном значении n изменяется от 0 до (n – 1), то, суммируя Z (n, l) по значениям l от 0 до (n – 1), получим 

Таблица 1
| Значения орбитального квантового числа l | |||||
| Символ соответствующего состояния электронов | s | p | d | f | g |
| Максимальное число электронов |
Принято говорить, что электроны в атоме, занимающие совокупность состояний с одинаковым значением главного квантового числа n, образуют электронный слой или оболочку. В зависимости от значений числа n различают следующие слои (оболочки): К (n = 1), L (n = 2), М (n = 3), N (n = 4) и т.д. по алфавиту.
В таблице 2 приведены значения максимального числа электронов, находящихся в состояниях, характеризуемых данными значениями главного n и орбитального l квантовых чисел.
Таблица 2
| Слой | Число электронов в состояниях | Максимальное число электронов | ||||
| s (l =0) | p (l =1) | d (l =2) | f (l =3) | g (l =4) | ||
| K L M N O | - | - - | - - - | - - - - |
Большим успехом физики явилось теоретическое истолкование периодической системы элементов Менделеева. Оно основано на следующих положениях:
1. Порядковый номер химического элемента равен общему числу электронов в атоме данного элемента.
2. Состояние электронов в атоме определяется набором четырех квантовых чисел n, l, m и ms. Распределение электронов в атоме по энергетическим состояниям должно удовлетворять принципу минимума потенциальной энергии: с возрастанием числа электронов каждый следующий электрон должен занять разрешенное энергетическое состояние с минимальной энергией.
Заполнение электронами энергетических состояний в атоме должно происходить в соответствии с принципом Паули.
9. Периодическая система элементов Д. И. Менделеева.
Периодическая система химических элементов - естественная классификация химических элементов, которая является графическим (табличным) выражением периодического закона химических элементов. Структура её, во многом сходная с современной, разработана Д. И. Менделеевым на основе периодического закона в 1869-1871 гг.
Прообразом периодической системы был "Опыт системы элементов, основанной на их атомном весе и химическом родстве", составленный Д. И. Менделеевым 1 марта 1869 г. На протяжении двух лет учёный непрерывно совершенствовал "Опыт системы", ввёл представление о группах, рядах и периодах элементов. В результате структура периодической системы приобрела во многом современные очертания.

Периодическая система химических элементов Д.И. Менделеева
Важным для её эволюции стало понятие о месте элемента в системе, определяемом номерами группы и периода. Опираясь на это понятие, Менделеев пришёл к выводу, что необходимо изменить атомные массы некоторых элементов: урана, индия, церия и его спутников. Это было первое практическое применение периодической системы. Менделеев также впервые предсказал существование нескольких неизвестных элементов. Учёный описал важнейшие свойства экаалюминия (будущего галлия), экабора (скандия) и экасилиция (германия). Кроме того, он предсказал существование аналогов марганца (будущих технеция и рения), теллура (полония), иода (астата), цезия (франция), бария (радия), тантала (протактиния). Прогнозы учёного в отношении данных элементов носили общий характер, поскольку эти элементы располагались в малоизученных областях периодической системы.
Первые варианты периодической системы во многом представляли лишь эмпирическое обобщение. Ведь был неясен физический смысл периодического закона, отсутствовало объяснение причин периодического изменения свойств элементов в зависимости от возрастания атомных масс. В связи с этим оставались нерешёнными многие проблемы. Есть ли границы периодической системы? Можно ли определить точное количество существующих элементов? Оставалась неясной структура шестого периода - каково точное количество редкоземельных элементов. Было неизвестно, существуют ли ещё элементы между водородом и литием, какова структура первого периода. Поэтому вплоть до физического обоснования периодического закона и разработки теории периодической системы перед ней не раз возникали серьёзные трудности. Неожиданным было открытие в 1894-1898 гг. плеяды инертных газов, которым, казалось, не находилось места в периодической системе. Эта трудность была устранена благодаря идее включить в структуру периодической системы самостоятельную нулевую группу. Массовое открытие радиоэлементов на стыке XIX и XX вв. (к 1910 г. их число составляло около 40) привело к резкому противоречию между необходимостью их размещения в периодической системе и её сложившейся структурой. Для них было только 7 вакантных мест в шестом и седьмом периодах. Эта проблема была решена в результате установления правил сдвига и открытия изотопов.
Одна из главных причин невозможности объяснить физический смысл периодического закона и структуру периодической системы состояла в том, что было неизвестно, как построен атом. Важнейшей вехой на пути развития периодической системы явилось создание атомной модели Э. Резерфордом (1911). На её основе голландский учёный А. Ван ден Брук (1913) высказал предположение, что порядковый номер элемента в периодической системе численно равен заряду ядра его атома (Z). Это экспериментально подтвердил английский ученый Г. Мозли (1913). Периодический закон получил физическое обоснование: периодичность изменения свойств элементов стала рассматриваться в зависимости от Z-заряда ядра атома элемента, а не от атомной массы.
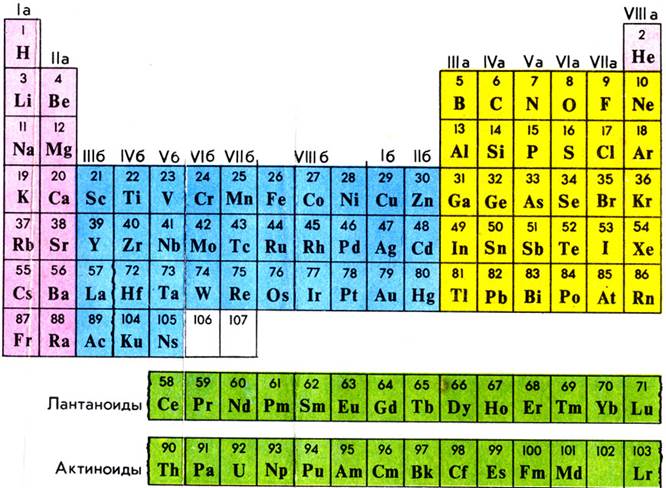
Длинная форма периодической системы элементов
В результате структура периодической системы значительно упрочилась. Была определена нижняя граница системы. Это водород - элемент с минимальным Z = 1. Стало возможным точно оценить количество элементов между водородом и ураном. Были определены "пробелы" в периодической системе, соответствующие неизвестным элементам с Z = 43, 61, 72, 75, 85, 87. Однако оставались неясными вопросы о точном количестве редкоземельных элементов и, что особенно важно, не были вскрыты причины периодичности изменения свойств элементов в зависимости от Z.
Опираясь на сложившуюся структуру периодической системы и результаты изучения атомных спектров, датский учёный Н. Бор в 1918-1921 гг. развил представления о последовательности построения электронных оболочек и подоболочек в атомах. Учёный пришёл к выводу, что сходные типы электронных конфигураций атомов периодически повторяются. Таким образом, было показано, что периодичность изменения свойств химических элементов объясняется существованием периодичности в построении электронных оболочек и подоболочек атомов.
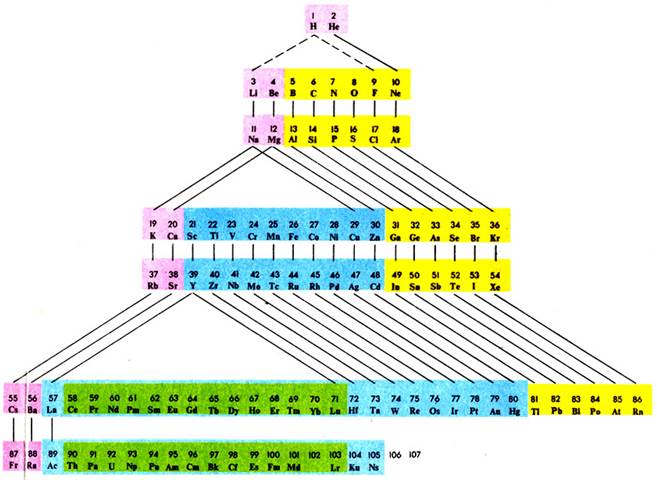
Лестничная форма периодической системы элементов
В настоящее время периодическая система охватывает 126 элементов. Из них все трансурановые элементы (Z = 93-107), а также элементы с Z = 43 (технеций), 61 (прометий), 85 (астат), 87 (франций) получены искусственно. За всю историю существования периодической системы было предложено большое количество (> 500) вариантов ее графического изображения, преимущественно в виде таблиц, а также в виде различных геометрических фигур (пространственных и плоскостных), аналитических кривых (спиралей и пр.) и т. д. Наибольшее распространение получили короткая, длинная и лестничная формы таблиц.
В настоящее время предпочтение отдается короткой.
Фундаментальным принципом построения периодической системы является её подразделение на группы и периоды. Менделеевское понятие рядов элементов ныне не употребляется, поскольку лишено физического смысла. Группы, в свою очередь, подразделяются на главную (а) и побочную (b) подгруппы. В каждой подгруппе содержатся элементы - химические аналоги. Элементы а- и b-подгрупп в большинстве групп также обнаруживают между собой определённое сходство, главным образом в высших степенях окисления, которые, как правило, равны номеру группы. Периодом называется совокупность элементов, которая начинается щелочным металлом и заканчивается инертным газом (особый случай - первый период). Каждый период содержит строго определённое количество элементов. Периодическая система состоит из восьми групп и восьми периодов.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1420; Нарушение авторских прав?; Мы поможем в написании вашей работы!