
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции замещения
|
|
|
|
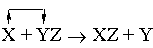
или

Примеры:
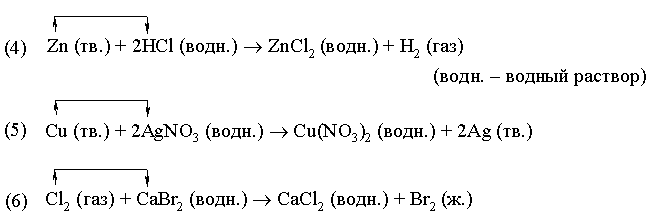
В реакции (4) металлический цинк замещает водород в соляной кислоте. В реакции (5) медь замещает серебро в нитрате серебра. В реакции (6) хлор замещает бром в бромиде кальция.
Реакции обмена (двойного замещения) XY + UV ® XV + UY
Примеры:
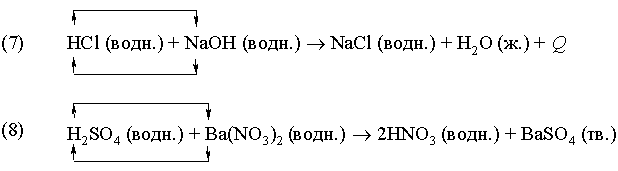
Реакция (7) – типичный пример кислотно-основной реакции (реакции нейтрализации), продуктами которой являются соль и вода. В реакции (8) в результате взаимодействия иона бария Ba2+, принадлежащего нитрату бария Ba(NO3)2, c сульфат-ионом  серной кислоты образуется осадок сульфата бария BaSO4. В реакциях (7) и (8) реагирующие вещества обмениваются катионами.
серной кислоты образуется осадок сульфата бария BaSO4. В реакциях (7) и (8) реагирующие вещества обмениваются катионами.
Реакции разложения (расщепления) 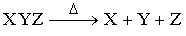
Примеры
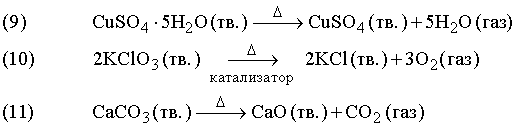
В реакции (9) синие кристаллы гидратированного сульфата меди разлагаются при нагревании, при этом гидратная вода превращается в пар. Реакция (10) протекает при относительно невысокой температуре в присутствии катализатора – диоксида марганца. Катализатор ускоряет химическую реакцию, оставаясь при этом неизменным (см. также КАТАЛИЗ). Реакция (11) применяется в промышленности: известняк (карбонат кальция CaCO3) при интенсивном нагревании разлагается, образуя негашеную известь (оксид кальция CaO) – важную составную часть цемента.
Обратимые реакции 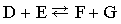 или
или 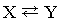
Стрелки в прямом и обратном направлениях указывают, что продукты реакции взаимодействуют с образованием исходных реагентов, другими словами, реакция идет в обоих направлениях. Систему, в которой протекает обратимая реакция, можно уподобить двум водоемам, соединенным узкой протокой, в которых обитают два или несколько видов рыб. Рыбы беспрепятственно переплывают из одного водоема в другой, так что в конце концов каждый водоем оказывается заселенным смешанной популяцией постоянного состава. Это и есть состояние равновесия.
Примеры:
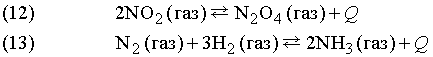
Количества исходных веществ и продуктов реакции сильно зависят от давления, температуры и концентрации реагирующих веществ.
Ионные реакции. Химические уравнения можно записывать с указанием заряда исходных веществ и продуктов реакции (+, –, 0 означают положительный, отрицательный и нулевой электрические заряды соответственно; их помещают вверху справа от символа химического элемента). Члены уравнения в правой и левой его частях, отвечающие группам атомов одинакового состава, несущих одинаковый заряд, можно сокращать, как это принято в алгебраических уравнениях:

Ион серебра Ag+ несет один положительный заряд; следовательно, на каждый атом меди, образующий двухзарядный положительный ион, должно приходиться два иона серебра, поскольку суммы зарядов в левой и правой частях уравнений должны быть одинаковы. После сокращения одинаковых членов в обеих частях уравнения получаем уравнение (16), которое выражает химические превращения, произошедшие в реакции. Приведенные выше уравнения – это три разных способа представления одной и той же химической реакции: ее молекулярная форма, полная и сокращенная ионные формы.
Ядерные реакции. Ядерные реакции можно отнести к химическим лишь весьма условно, поскольку в них элемент превращается в изотоп того же элемента или другой элемент. Иногда какая-то часть вещества в ядерной реакции исчезает, и этот процесс сопровождается высвобождением огромного количества энергии; такие процессы происходят при взрыве атомной бомбы или в ядерном реакторе. Обычно в уравнениях ядерных реакций фигурируют нейтроны ( ), протоны (
), протоны (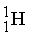 ), электроны (
), электроны (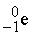 ), a -частицы (
), a -частицы (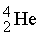 ), g -лучи (
), g -лучи ( ) и позитроны (
) и позитроны (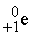 ). Верхний левый индекс обозначает массу частицы, а нижний левый – ее заряд. Приведем уравнения типичных ядерных реакций:
). Верхний левый индекс обозначает массу частицы, а нижний левый – ее заряд. Приведем уравнения типичных ядерных реакций:
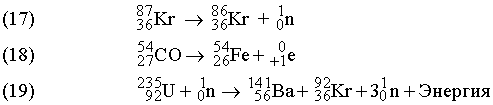
Суммы верхних индексов в левой и правой частях уравнения должны быть одинаковыми; то же самое относится к нижним индексам. Может показаться, что масса вещества в ходе ядерных реакций (17)–(19) не изменяется. В действительности же вследствие взаимодействия элементарных частиц в ядре и изменения их массы покоя у продуктов масса может оказаться чуть меньше, чем у исходных веществ. Именно с исчезновением этого незначительного количества вещества, которое превращается в энергию согласно уравнению Эйнштейна Е = mc 2, и связана разрушительная сила ядерного взрыва. Протекающая при этом реакция описывается уравнением (19). В уравнении (17) 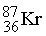 ((криптон) испускает нейтрон с образованием изотопа с тем же атомным номером (36), но массой, меньшей на единицу.
((криптон) испускает нейтрон с образованием изотопа с тем же атомным номером (36), но массой, меньшей на единицу.
Окислительно-восстановительные реакции. В ходе окислительно-восстановительной реакции меняется заряд элементов (их степень окисления), что и учитывается при написании уравнения. Потеря электрона называется окислением, а приобретение – восстановлением. Число отданных и приобретенных в ходе реакции электронов должно быть одинаковым, и исходя из этого устанавливаются соотношения между всеми участниками реакции. Рассмотрим реакцию
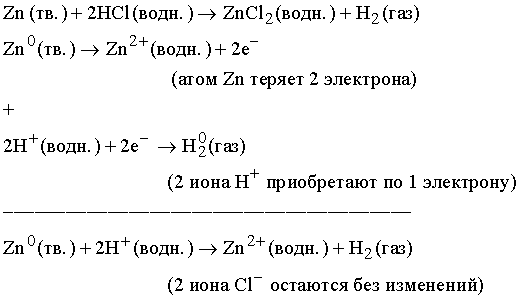
Приведем более сложный пример – окислительно-восстановительную реакцию между медью и концентрированной азотной кислотой:

В ходе этой реакции Сu0 теряет 2 электрона, превращаясь в ион Сu2+, а N5+ принимает 1 электрон, превращаясь в N4+. Чтобы уравнять число отданных электронов с числом приобретенных, вводим коэффициент 2 перед NO2 в правой части, а чтобы число атомов азота при этом осталось прежним, умножаем HNO3 в левой части на 2. Cu(NO3)2 в правой части содержит два иона степень окисления N в которых равна +5. Чтобы сохранить число ионов в левой части с той же степенью окисления, добавляем в левой части 2 молекулы HNO3. Далее, чтобы уравнять 4H+, содержащихся в молекулах HNO3, записываем в правой части 2H2O. В левой части имеем 3×4 = 12 ионов кислорода, содержащихся в кислоте. Эти 12 ионов кислорода присутствуют и в правой части: 2 в воде, 4 в NO2 и 6 в нитрате меди Cu(NO3)2. Аналогичным образом можно записывать любые, более сложные уравнения.
Применение. Химические уравнения используются химиками-технологами при расчете характеристик производственных процессов. Так, с их помощью определяется количество реагентов (сырья), необходимое для получения данного количества продукта. См. также ХИМИЯ.
7. рСтроение атома.
8. Строение электронных оболочек атомов. Электронные формулы. Принцип Паули.
СТРОЕНИЕ ЭЛЕКТРОННЫХ ОБОЛОЧЕК АТОМОВ
В разделе "Сведения о строении атома" вы познакомились с планетарной моделью атома, согласно которой вокруг положительного ядра движутся электроны, которые образуют электронные оболочки атома. Электроны различаются своей энергией, чем дальше от ядра расположены электроны тем большим запасом энергии они обладают. Всегда в атоме имеются электроны С близкими значениями энергии, которые и образуют электронные слои в оболочке атома.
Число электронных слоёв равно номеру периода в периодической системе. Максимальное число электронов на слое можно найти с помощью формулы N=2n2,где N -число электронов на слое, n -номер слоя. Произведя простые рассчёты, выясним что на первом электронном слое будет 2 электрона, на втором-8, третьем-18, четвёртом-32. Но на внешнем электронном слое не может быть более 8 электронов, а для первого слоя не более 2. Это небходимо учитывать при распределении электронов по энергетическим слоям.
Рассмотрим несколько примеров заполнения электронных оболочек.
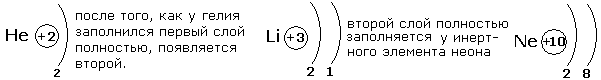
После заполнения второго слоя до восьми электронов появляется третий слой.


Третий электронный слой заполняется до максимального числа -18 электронов. После этого начинает заполняться внешний четвёртый слой до 8 электронов.

Внешний электронный слой заполняется у элементов главных подгрупп, причём число электронов соответствует номеру группы. У элементов побочных подгрупп заполняются предвнешние слои, а на внешнем слое остаётся чаще всего два электрона. У d-элементов заполняется предвнешний слой, а у f-элементов третий снаружи слой.
Распределение электронов по уровням можно записать с помощью ячеек Хунда:
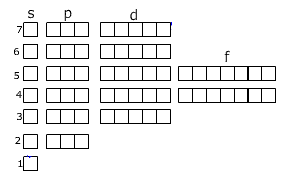
Здесь уровни разделены на подуровни. Вы наверное заметили, что в периодической системе элементы подразделяются на s-, p-, d-, f-элементы. Какой подуровень заполняется последним, к такой группе и относится данный элемент. Например, последний электрон занимает одну из р-орбиталей, то этот элемент относится к р-элементам.
При заполнении ячеек электроны обозначаются стрелками (одна стрелка направлена вверх, другая вниз, это связано с тем, что электроны вращаются вокруг своей оси-один по часовой, другой-против часовой стрелки), причём в одной ячейке могут находиться не более двух электронов.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1976; Нарушение авторских прав?; Мы поможем в написании вашей работы!