
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химический потенциал. Существуют многокомпонентные системы, состоящие из большого числа фаз, причём их состав меняется в зависимости от температуры
|
|
|
|
Существуют многокомпонентные системы, состоящие из большого числа фаз, причём их состав меняется в зависимости от температуры, давления и т.д. Если в системе имеется несколько компонент, то её внутренняя энергия зависит от концентрации n i каждой из компонент. В качестве других независимых переменных, от которых зависит внутренняя энергия, удобно взять объём V и энтропию S, т.е. записать
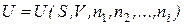 . (1.143)
. (1.143)
Тогда
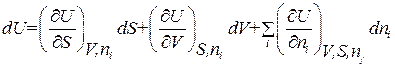 , (1.144)
, (1.144)
где суммирование производится по всем ni, а при взятии частной производной по ni остальные ni ≠ nj считаются постоянными. Учитывая, что (см. 1.119)

получим
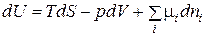 , (1.145)
, (1.145)
где 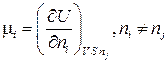 . (1.146)
. (1.146)
Аналогично, с учётом переменного числа частиц можно модифицировать и остальные термодинамические функции. Например, термодинамический потенциал Гиббса G будет выглядеть так:
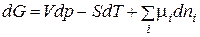 , (1.147)
, (1.147)
где  . (1.148)
. (1.148)
Похоже будут выглядеть выражения для энтальпии и свободной энергии:
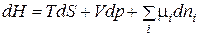 , (1.149)
, (1.149)
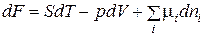 . (1.150)
. (1.150)
Здесь
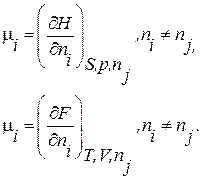 (1.151)
(1.151)
Величина μ i называется химическим потенциалом. Формулы (1.151), (1.148) и (1.146) дают его выражение при различных переменных, принятых за независимые.
Основываясь на выражении (1.145), можно записать первое и второе начала термодинамики для системы с переменным числом частиц:
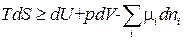 . (1.152)
. (1.152)
Химический потенциал является важной величиной, характеризующей равновесие фаз, состоящих из нескольких компонентов. Две фазы находятся в равновесии тогда, когда на их границе выполняются условия:
 ,
,  ,
, 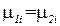 .
.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 357; Нарушение авторских прав?; Мы поможем в написании вашей работы!