
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Работа газаи внутренняя энергия
|
|
|
|
К категории обратимых относятся процессы, для которых допускается возвращение в исходное состояние без каких либо изменений в окружающей среде. При этом прямой и обратный процессы должны проходить через одну и туже последовательность равновесных состояний. Реально в природе такие процессы не наблюдаются, но они, так же как модель идеального газа, являются удобной идеализацией, позволяющей построить описание, близкое к реальному описанию в целом ряде практически важных случаев. При этом используется модель квазистатического процесса, то есть такого процесса, который протекает с бесконечно малой скоростью. При таких процессах термодинамическая система проходит через последовательность равновесных состояний, так как все возмущения, возникающие при переходе из одного состояния в другое, успевают затухнуть из-за очень малой скорости перехода. Описанием обратимых термодинамических процессов занимается равновесная термодинамика.
Равновесные и неравновесные состояния (не путать со стационарными состояниями): состояние при котором P,V,T–const.
Равновесные состояния и равновесные процессы
Термодинамические параметры P,V,T,(и количество вещества ν – число молей).
Т/дин-е равновесие (Т/д равновесное состояние)
Равновесный (квазистатический) процесс в термодинамике, процесс перехода термодинамической системы из одного равновесного состояния в другое, столь медленный, что все промежуточные состояния можно рассматривать как равновесные, т. е. характеризующиеся очень медленным (в пределе — бесконечно медленным) изменением термодинамической параметров состояния. Р. п.— одно из основных понятий термодинамики равновесных процессов. Всякий Р. п. является обратимым процессом и, наоборот, любой обратимый процесс – равновесный.
1. Термодинамические параметры P,V,T. Уравнение состояния
| f (T, P, V) = 0, |
Соотношение, связывающее термодинамические параметры
называется уравнением состояния. Вид этого уравнения зависит от конкретных свойств вещества.
Для идеального газа PV = n RT,
Написанное уравнение можно разрешить относительно одной из переменных, выразив ее через две других. Поэтому состояние системы полностью определяется какими-либо двумя переменными, например, P и V. Все термодинамические параметры и их функции являются либо функциями состояния, либо функциями процесса.
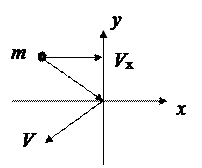
Элементарный вывод уравнения состояния идеального газа:
При упругом ударе молекулы о стенку  .
.
Давление N молекул  .
.
Концентрация молекул 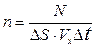 .
.
Квадрат модуля средней скорости 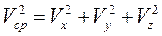 .
.
В равновесном состоянии 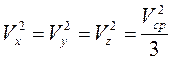
Давление газа  .
.
Средняя кинетическая энергия молекулы  .
.
Окончательно 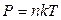 .
.
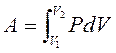 – функция процесса.
– функция процесса.
V 1 и V 2– начальный и конечный объемы, давление – функция объема P = f (V).
Феноменологически внутренняя энергия определяется как однозначная функция состояния системы, зависящая от температуры U = f (T) она есть полный дифференциал,  и подлежит экспериментальному измерению.
и подлежит экспериментальному измерению.
МКТ даёт кинетическую трактовку, как внутренней энергии, так и температуры:

 (это для ид. газа, т.е. в пренебрежении потенциальной энергией взаимодействия молекул между собой).
(это для ид. газа, т.е. в пренебрежении потенциальной энергией взаимодействия молекул между собой).
Универсальная газовая постоянная
R = k×N A=1,38×10–23 6,02×1023 = 8,31 Дж/моль/K. – Работа 1-го моля газа при изобарическом процессе и изменении температуры на 1К.
Геометрическая интерпретация
работы
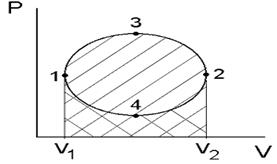
Работа кругового процесса
3. Температура – новое понятие, которое отсутствует в механике. В т/д-ке – это постулат, называется нулевым законом термодинамики.
Система, находящаяся в тепловом равновесии, имеет во всех точках одинаковую температуру. Это – необходимое условие теплового равновесия. Измерение температуры основано на уравнении состояния:
 , где V м – молярный объём
, где V м – молярный объём
Температура является функцией состояния: она не зависит от предыстории тела и полностью определяется его состоянием в данный момент.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 415; Нарушение авторских прав?; Мы поможем в написании вашей работы!