
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні закони хімії
|
|
|
|
Одним з основних законів хімії є закон збереження маси речовини. Цей закон був відкритий Ломоносовим у 1748 р. і доповнений французьким ученим А. Лавуазьє у 1789 р. Сучасне формулювання закону збереження маси таке: маса речовин, які вступають у хімічну реакцію, дорівнює масі речовин, які утворюються внаслідок реакції.
Наступним кроком у розвитку хімії стало встановлення закону про сталість складу речовини, сформульованого французьким ученим Жозефом Прустом у 1808 році. Закон сталості складу речовини стверджує, що кожна хімічно чиста речовина має сталий склад, незалежно від умов і способів її добування.
Закон об’ємних відношень газів. Цей закон у 1808 році сформулював французький учений Жозеф Луї Гей-Люссак. Сьогодні цей закон відомий як хімічний закон Гей-Люссака. Він звучить так: об’єми газів, що вступають у реакцію, відносяться один до одного і до об’ємів добутих газоподібних продуктів як невеликі цілі числа: 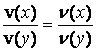 .
.
Виявлену Гей-Люссаком закономірність пояснює закон, відкритий у 1811 р. італійським ученим Амедео Авогадро: в однакових об’ємах різних газів за однакових умов (температури та тиску) міститься однакова кількість молекул.
Із канону Авогадро випливають два важливі наслідки.
Перший наслідок: один моль будь-якого газу за однакових умов займає однаковий об’єм. За нормальних умов (н. у.) (це тиск 101,325 кПа кілопаскаль і температура 0 °С) об’єм 1 моль будь-якого газу дорівнює 22,4 л. Цей об’єм називають молярним об’ємом газу за нормальних умов. Другий наслідок із закону Авогадро: відношення мас однакових об’ємів газів за однакових умов дорівнює відношенню їхніх молярних мас: 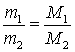 .
.
Періодичний закон. На підставі атомно-молекулярного вчення і хімічних властивостей елементів Дмитро Іванович Менделєєв 1 березня 1869 року відкрив періодичний закон – один із основних законів природи. Сучасне формулювання періодичного закону таке: властивості елементів, а також властивості утворених ними простих і складних речовин перебувають у періодичній залежності від зарядів ядер їх атомів.
Тема 2
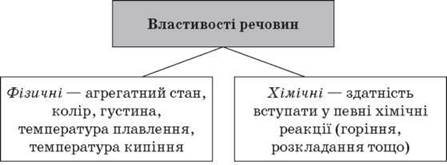
1. Речовини та їх властивості
Речовина — це те, із чого складається фізичне тіло. З однієї речовини можна виготовити різні тіла. Які тіла можна виготовити з дерева; із пластмаси? Назвіть схожі тіла, що складаються з разних речовин. Речовини можуть бути природними і штучними, тобто синтезованими людиною.
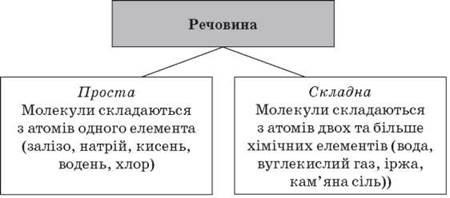
Хімі́чний елеме́нт (заст. первень [1]) — тип атомів з однаковим зарядом атомних ядер (тобто однаковою кількістю протонів в ядрі атому) і певною сукупністю властивостей. Маса ядра атома хімічного елементу може бути різною, в залежності від кількості нейтронів у ньому. Сукупність атомів елементу з однаковою масою називається нуклідом, а ізотопами називаються атоми одного елементу з різними масами. Атоми даного хімічного елементу відрізняються від атомів інших елементів величиною заряду ядра, кількістю та характером розміщення електронів навколо ядра, розмірами і хімічними властивостями. У нейтрального атома число електронів наелектронних оболонках дорівнює заряду ядра. У разі, коли кількість електронів не збігається з кількістю протонів у ядрі, утворюється йон, однак це іон відповідного хімічного елемента.
Кількість атомів хімічного елемента не змінюється при хімічних реакціях. Для перетворення атома одного хімічного елемента в інший необхідні ядерні реакції. Зокрема, за допомогою ядерних реакцій отримують нові хімічні елементи, які не існують у природі. На 2010 рік було відомо 118 хімічних елементів: з них 89 виявлені в природі, інші отримані штучно в результаті ядерних реакцій.Усі відомі нині речовини а їх уже 20 000 000.Утворені атомами різнх хімічних елементів.
Вперше поняття хімічного елемента сформулював Роберт Бойль у 1661 році. Термін елемент має у своїй основі уявлення древніх про первинні стихії, з яких на їхню думку складалася матерія: вода, повітря, земля, вогонь. Бойль назвав хімічними елементами речовини, які жодним чином не можна було розкласти на простіші. Він також показав, що таких хімічних елементів більше, ніж чотири. У 1789 році Лавуазьє опублікував список 33 відомих на той час елементів, до яких він також включивсвітло й теплець. До 1818 року Барцеліус визначив атомні маси 45 з 49 визнаних на той час хімічних елементів. У періодичній таблиці, яку склав Менделєєв, було 66 хімічних елементів. У 1913 році Генрі Мозлі відкрив те, що атомний номер хімічного елемента збігається з зарядом його ядра.
Окрім 89 хімічних елементів, виявлених в природі, інші отримані штучно внаслідок ядерних реакцій (атоми технецію, прометію, протактинію, плутонію в надмалих кількостях були виявлені в уранових і торієвих мінералах).
Ядро атома складається з протонів (число яких відповідає атомному числу хімічного елемента) і нейтронів; число останніх може бути різним. Атоми хімічних елементів з однаковим числом протонів, але з різним числом нейтронів називаються ізотопами. За своїми хімічними властивостями ізотопи хімічних елементів практично не відрізняються між собою.
Атом з конкретним числом протонів і нейтронів називається нуклідом. Нуклід характеризується масовим числом — загальною кількістю нуклонів.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 1643; Нарушение авторских прав?; Мы поможем в написании вашей работы!