
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічні властивості. Переважна більшість живих організмів має аеробне дихання, тобто використовує кисень повітря
Тема 5
Переважна більшість живих організмів має аеробне дихання, тобто використовує кисень повітря. Повітря є скрізь, де існують живі організми: на суходолі, у воді, у ґрунті.
Значення повітря
Властивості повітря
Атмосфера
Повітря — природна суміш
Простір навколо нас наповнений повітрям. Повітря утворює атмосферу — газову оболонку Землі, що сягає висоти 100 км над поверхнею планети.
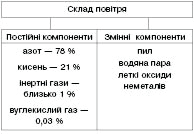
Вуглекислий газ і водяна пара змінюють процентне співвідношення залежно від різних умов. Вуглекислого газу багато в повітрі промислових міст, а водяної пари — у повітрі над водяною поверхнею.
Повітря є прозорим. Товстий шар повітря має блакитний колір.
Повітря (кисень повітря) підтримує горіння (один зі способів гасіння пожеж — використання цупкої тканини, яка перепиняє доступ повітря до вогню).
Повітря погано проводить тепло. Візьмемо дві склянки з гарячою водою й накриймо одну скляною ємністю, у відкритій склянці вода холоне швидше, тому що другу склянку захищено шаром повітря — принцип термоса.
Тепле повітря підіймається вгору, а холодне — опускається донизу. Процес переміщування повітряних шарів, коли нагріте повітря піднімається вгору, а на його місце приходить прохолодніше, називається конвекцією. Завдяки конвекції в природі переміщуються великі об’єми повітря.
Вода́, Н2O — хімічна речовина у вигляді прозорої безбарвної рідини без запаху і смаку, (в нормальних умовах). У природі існує у трьох агрегатних станах — твердому (лід), рідкому (вода) і газоподібному (водяна пара). Молекула води складається з одного атома Оксигену і двох атомів Гідрогену. Атоми Гідрогену розташовані в молекулі так, що напрямки до них утворюють кут 104,45o із вершиною в центрі атома Оксигену. Таке розташування зумовлює молекулі води дипольний момент у 1,844Дебая. При заміні атомів Гідрогену (протонів) на атоми дейтерію утворюється модифікація, яка називається важкою водою.
Вода — одна із найголовніших речовин, потрібних для органічного життя. Рослини та тварини містять понад 60 % води за масою. На Землі водою покрито 70,9% поверхні. Вона здійснює у природі постійний кругообіг, випаровуючись з поверхні й повертаючись на неї у вигляді опадів. Вода має велике значення для економіки: сільського господарства й промисловості.Питна вода становить тільки 2,5% від загальної кількості. Нестача води може стати однією з найважчих проблем людства в найближчі десятиліття.
Зміст
[сховати]
· 1 Поширення в природі
o 1.1 У Всесвіті
§ 1.1.1 У Сонячній системі
o 1.2 На Землі
· 2 Фізичні властивості
o 2.1 Вода як розчинник
o 2.2 Прозорість води
· 3 Хімічні властивості
· 4 Роль води в природі та житті
o 4.1 Шкідливість та небезпека води
· 5 Вода у техніці
· 6 Якість води
· 7 Очищення природної води
· 8 Гідрологія
· 9 Див. також
· 10 Виноски
· 11 Джерела
· 12 Посилання
Поширення в природі[ред. • ред. код]
У Всесвіті[ред. • ред. код]
Хімічні елементи, які входять до складу води, Гідроген і Оксиген, належать до найпоширеніших у природі. Утворення води з цих елементів відбувається там, де густина газів достатньо велика і зіткненням між атомами достатньо ймовірне. Вода виявлена в складі міжзоряних газових хмар, що лежать у межах нашої галактики - Чумацького Шляху.
У Сонячній системі[ред. • ред. код]
Одним з найважливіших питань, пов'язаних з освоєнням космосу людиною і можливістю виникнення життя на інших планетах, є питання про наявність води за межами Землі в достатній концентрації. Відомо, що деякі комети більше, ніж на 50% складаються з водяного льоду. Не варто, втім, забувати, що не будь-яке водне середовище придатне для життя — зокрема, акумуляторна батарея містить 25%-ий розчин сірчаної кислоти у воді (але життя в ньому, очевидно, є маловірогідним, тим більше, його виникнення).
У результаті бомбардування місячного кратера, проведеного 9 жовтня 2009 року НАСА з використанням космічного апаратуLCROSS, вперше були отримані достеменні свідчення наявності на супутнику Землі водяного льоду у великих обсягах[1].
Точно з'ясовано, що вода у замерзлому стані є на поверхні Марсу.
Рідка вода, імовірно, є під поверхнею деяких супутників планет, найімовірніше, на Європі, супутнику Юпітера.
На Землі[ред. • ред. код]

Краплини води (роса) на павутинці
Докладніше: Кругообіг_води
Вода належить до найпоширеніших речовин на Земній кулі[ Джерело? ]. Водою вкрито близько 2/3 поверхні земної кулі (океани,моря, озера, річки). Значна її кількість у вигляді льоду і снігу вкриває високі гори і величезні простори Арктики і Антарктиди. Багато води в атмосфері — пара, туман і хмари. Значні кількості води містяться і в земній корі у вигляді підземних вод. У природі вода перебуває не тільки у вільному стані, а і в хімічно зв'язаному.
Вода входить до складу багатьох гірських порід і всіх рослинних і тваринних організмів. На воду припадає близько 60% маси тварин і до 80% маси риб. У деяких рослинах вміст води іноді перевищує 90% їхньої маси.
Більшість запасів води на Землі знаходяться в морях і океанах, прісна вода становить 2,5-3% від загального об'ємугідросфери.
Фізичні властивості[ред. • ред. код]
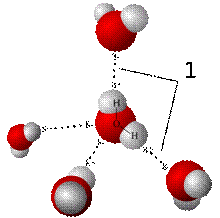
Спрощена просторова модель формування водневих зв'язків між молекулами води
Чиста вода — безбарвна прозора рідина, без запаху і смаку. На землі вода існує в трьох агрегатних станах — твердому, рідкому тагазоподібному. За нормального атмосферного тиску при 0°С вона замерзає і перетворюється у лід, а при 100°С — кипить, перетворюючись у пару. У газоподібному стані вода існує і за нижчої температури, навіть нижче 0°С. Тому лід і сніг теж поступово випаровуються.
У рідкому стані вода практично не стискається, при замерзанні розширюється на 1/11 від свого об'єму.
Найбільшу густину вода має при +4°С. Масу 1 см³ чистої води при цій температурі прийняли за одиницю і назвали грамом(сучасне визначення грама основане на точнішому еталоні). На відміну від інших рідин, вода при охолодженні від + 4 до 0°Срозширюється. Тому лід легший від води (на 8%) і не тоне у ній. Завдяки цьому, а також малій теплопровідності шар льоду захищає глибокі водойми від промерзання до дна, і цим забезпечується у них життя.
Потрійна точка води, тобто умови, за яких одночасно у рівноважному стані можуть співіснувати вода, лід та пара, реалізується притемпературі 0,01 °C і тиску 611,73 Па. Значення 0,01 °C точне — на ньому основане визначення одиниці вимірювання температури в Міжнародній системі (СІ), кельвіна. Проте відповідно до запропонованих змін у СІ, коли значення сталої Больцманата числа Авогадро буде зафіксовано, температура потрійної точки води буде визначатися з похибкою.
Вода характеризується великою питомою теплоємністю, що дорівнює за означенням калорії 1 кал/г-град. Завдяки цьому температура океанів і морів змінюється досить повільно, і цим регулюється температура на поверхні земної кори. Цим пояснюється також те, що клімат на островах рівномірніший, ніж на материках.
Фізичні властивості води великою мірою зумовлені тим, що її молекули мають значний дипольний момент (1,844 Дебая). Оскільки атоми Оксигену є більш електронегативними, ніж атоми Гідрогену, вони відтягують на себе електронну густину ковалентних зв'язків у молекулах води. Через це на перших (O) виникає частковий негативний заряд (2δ-), а на других (H) — вдвічі менший за значенням позитивний заряд (δ+). Внаслідок електростатичного притягування між атомами Гідрогену й Оксигену сусідніх молекул води, між ними формується водневий зв'язок[2]. Завдяки такій взаємодії конденсація води відбувається при порівняно високій температурі. Так, наприклад, набагато важчі молекули кисню і вуглекислого газу при цих температурах конденсованої фази не утворюють.
У будь-який момент часу в рідкій воді більшість молекул утворюють водневі зв'язки, проте час життя кожного з них дуже короткий (від 1 до 20 пс). Після руйнування одного зв'язку наступний, із тим же або іншим партнером, утворюється приблизно через 0,1 пс. Тимчасові групи молекул води, сполучених між собою водневими зв'язками, називають «кластерами, що мигають». Сила водневих зв'язків досить невелика (енергія розриву 23 кДж/моль), проте вони дуже суттєво впливають на властивості води, через їх велику кількість[2].
Завдяки своїй формі молекули води можуть сполучатись водневими зв'язками із чотирма іншими. Саме таким чином вони організовані у кристалах льоду. Проте в рідкій воді молекули менш впорядковані і перебувають у стані постійного руху, тому середня кількість зв'язків, що утворюються кожною із них, в будь-який момент часу становить 3,6[2].
Вода як розчинник[ред. • ред. код]

Схематичне зображення гідратної оболонки навколо іону натрію
Вода — це полярний розчинник, в ній добре розчиняються полярні і заряджені сполуки, які ще називають гідрофільними. Речовини, що складаються із неполярних молекул, у воді не розчиняються, їх називають гідрофобними. Гідрофобними, а отже і погано розчинними, зокрема є такі гази як кисень і вуглекислий газ. Тому багато живих організмів, в тому числі і людина, мають спеціальні транспортні білки, такі як гемоглобін та міоглобін, для перенесення кисню по тілу, а вуглекислий газ в крові перебуває у формі бікарбонату (HCO-3)[3].
Здатність води ефективно розчиняти полярні і заряджені речовини зумовлена високою діелектричною проникністю, її діелектрична стала при температурі 25 °C становить 78,5 (для порівняння діелектрична стала неполярного розчинника бензену при тій же температурі 4,6). Це означає, що вода може ефективно екранувати електростатичні взаємодії між розчиненими іонами. Наприклад, під час розчинення хлориду натрію молекули води утворюють гідратні оболонки навколо іонів Na+ і Cl-, таким чином стабілізують їх, частково нейтралізують їхні заряди, і не дозволяють взаємодіяти одне з одним утворюючи кристали[4].
Існують також амфіфільні речовини, молекули яких мають гідрофобну і гідрофільну частини. Коли такі речовини потрапляють у воду, їхні полярні частини вступають у взаємодію з молекулами води, в той час як гідрофобні навпаки такої взаємодії уникають. Таким чином завдяки так званим гідрофобним взаємодіям амфіфільні речовини формують у воді міцели[5].
Молекули води мають слабку здатність до зворотної іонізації шляхом розпаду на протон H+ і гідроксид-іон OH-:
H2O 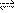 H+ + OH-;
H+ + OH-;
Попри те, що одним із продуктів дисоціації є протони, вони не існують у воді у вільному стані, а натомість відразу ж приєднуються до молекул H2O з утворенням іонів гідронію H3O+. Внаслідок іонізації чиста вода до певної міри може проводити електричний струм. При чому гідроксид- і гідроній-іони в електричному полі рухаються значно швидше ніж інші іони. Це пояснюється явищем «перестрибування протонів»: жоден індивідуальний іон не переміщується на великі відстані, натомість відбувається перенесення протонів між молекулами води, з'єднаними між собою водневими зв'язками. Таким чином виникає сумарний рух гідроній-іонів до катода, а гідроксид-іонів — до анода. «Перестрибування протонів» також призводить до того, що у водних розчинах дуже швидко проходять кислотно-основні реакції[6].
У стані рівноваги тільки невеличка частина молекул води іонізовані, так при температурі 25 °C на іони розпадається приблизно одна молекула із півмільярда. Іонний добуток води ({H+}×{OH-}, де {H+} і {OH-} — активності відповідних іонів) є сталою величиною і становить 1×10−14 M2, оскільки у чистій воді концентрації (і активності) іонів OH- і H+ рівні, то кожна з них рівна 1×10−7 M2. Негативний десятковий логарифм із {H+} називається pH (водневий показник), відповідно для чистої води, яка є абсолютно нейтральною, він становить 7[7].
У хімічному відношенні вода досить активна. З багатьма речовинами вона вступає в хімічні реакції вже при звичайній температурі. З оксидами лужних і лужноземельних металів вона утворює основи:
· СаО + Н2О = Са(ОН)2
З багатьма оксидами неметалів (ангідридами) вода утворює кисневмісні кислоти:
· Р2О5 + 3Н2О = 2Н3РО4
З найактивнішими металами вона утворює основи з виділенням водню:
· 2Na + 2Н2О = 2NaOH + Н2 ↑
З деякими солями вода утворює так звані кристалогідрати, які характеризуються строго визначеною кількістю молекул води, що припадають на одну молекулу солі. Наприклад, з сульфатом міді вода утворює мідний купорос:
· CuSO4 + 5Н2О = CuSO4 • 5Н2О
в якому на одну молекулу сульфату міді припадає п'ять молекул води. Воду, що входить до складу кристалів, називають кристалізаційною.
Кристалізаційну воду не слід плутати з гігроскопічною водою, яка поглинається (адсорбується) поверхнею і порами всіх речовин на відкритому повітрі. Деякі речовини відзначаються підвищеною здатністю поглинати вологу повітря. Внаслідок цього вони мокріють (наприклад, NaCl), а то й і розпливаються на повітрі (як CaCl2). Такі речовини називають гігроскопічними. На відміну від кристалізаційної, кількість гігроскопічної води в речовинах, змінна. Вона хімічно не взаємодіє з речовиною-адсорбантом.
При високій температурі водяна пара взаємодіє з залізом і іншими речовинами. Наприклад:
· 3Fe + 4Н2О = Fe3О4 + 4Н2
Раніше цю реакцію застосовували в техніці для добування водню.
У термічному відношенні вода досить стійка. Проте при температурах, вищих 1000°С, вона починає розкладатися на водень і кисень:
· 2Н2О = 2Н2 + O2
Хімічна сумісність вод – здатність вод не утворювати твердих осадів при їх змішуванні
Розчинні й нерозчинні речовини.
(а) Слово вчителя; б) повідомлення учнів; в) демонстрація дослідів.)
Отже, вода має здатність розчиняти деякі речовини. Проте не всі речовини можна розчинити у воді. Речовини, які розчиняються у воді,— це розчинні, які не розчиняються — нерозчинні.
Для того щоб розрізняти їх, проведемо кілька дослідів.
Дослід 1. Насипаємо до склянки з водою ложку цукру. Розмішуємо його і спостерігаємо.
— Що відбувається із цукром? (Те ж, що і з сіллю, він зникає.)
— Чому він «зникає»? (Він розчиняється у воді.)
Отже, цукор є розчинною речовиною.
Дослід 2. У склянку з водою насипаємо ложку чистого промитого річкового піску. Розмішуємо його і спостерігаємо.
— Що відбувається з водою? (Вона змінила колір та прозорість.)
— Що відбувається із часточками піску? (Нічого.)
Проціджуємо воду крізь паперовий фільтр.
— Чи змінюються властивості води? (Так, вона стає прозорою та безбарвною.)
— Куди подівся пісок? (Він залишився на паперовому фільтрі.)
Отже, пісок є нерозчинною речовиною.
Таким чином ми можемо перевірити будь-яку речовину на розчинність у воді (що ви і зможете зробити під час дослідницького практикуму). Кожного разу ви маєте робити висновок про те, розчинна це речовина чи ні. Тому запам’ятаємо: якщо часточки речовини стають у воді невидимими і проникають разом із водою крізь фільтр — це розчинна речовина; якщо часточки речовини плавають у воді або осідають на дно і затримуються фільтром — це нерозчинні речовини.
Наприклад, у воді розчиняються сіль, цукор, марганець, миш’як.
Нерозчинними у воді є пісок, олово, бензин, алюміній.
тема 6
|
|
Дата добавления: 2015-05-09; Просмотров: 1117; Нарушение авторских прав?; Мы поможем в написании вашей работы!