
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Элементы квантовой механики
|
|
|
|
- Корпускулярно-волновой дуализм свойств вещества. Гипотеза де Бройля.
Де Бройль утверждал, что не только фотоны, но и электроны и любые другие частицы материи наряду с корпускулярными обладают также волновыми свойствами.
Итак, согласно де Бройлю, с каждым микрообъектом связываются, с одной стороны, корпускулярные характеристики — энергия Е и импульс p, а с другой — волновые характеристики — частота n и длина волны l. Количественные соотношения, связывающие корпускулярные и волновые свойства частиц, такие же, как для фотонов:
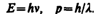 (213.1)
(213.1)
Смелость гипотезы де Бройля заключалась именно в том, что соотношение (213.1) постулировалось не только для фотонов, но и для других микрочастиц, в частности для таких, которые обладают массой покоя. Таким образом, любой частице, обладающей импульсом, сопоставляют волновой процесс с длиной волны, определяемой по формуле де Бройля:
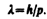 (213.2)
(213.2)
Это соотношение справедливо для любой частицы с импульсом р.
Представление о двойственной корпускулярно-волновой природе частиц вещества углубляется еще тем, что на частицы вещества переносится связь между полной энергией частицы e и частотой n волн де Бройля:
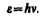 (213.3)
(213.3)
- Соотношение неопределенностей Гейзенберга.
В 1927 г. немецкий физик-теоретик В. Гейзенберг сформулировал принцип неопределенности, заключающийся в принципиальной невозможности одновременно точно определить положение микрочастицы в пространстве и ее импульс:
Δ px · Δ x ≥ h / 2π,
где Δ px = m Δ vx x - неопределенность (ошибка в определении) импульса микрообъекта по координате х; Δ x - неопределенность (ошибка в определении) положения микрообъекта по этой координате.
- Волновая функция. Её свойства и статистический смысл.
по волновому закону меняется не сама вероятность, а величина, названная амплитудой вероятности и обозначаемая Y(х, у, z, t). Эту величину называют также волновой функцией (или Y-функцией). Амплитуда вероятности может быть комплексной, и вероятность W пропорциональна квадрату ее модуля:
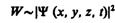 (216.1)
(216.1)
(|Y|2=YY*, Y * — функция, комплексно сопряженная с Y). Таким образом, описание состояния микрообъекта с помощью волновой функции имеет статистический, вероятностный характер: квадрат модуля волновой функции (квадрат модуля амплитуды волн де Бройля) определяет вероятность нахождения частицы в момент времени t в области с координатами х и x+dx, у и y+dy, z и z+dz.
Итак, в квантовой механике состояние микрочастиц описывается принципиально по-новому — с помощью волновой функции, которая является основным носителем информации об их корпускулярных и волновых свойствах. Вероятность нахождения частицы в элементе объемом d V равна
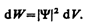 (216.2)
(216.2)
Величина
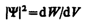
(квадрат модуля Y-функции) имеет смысл плотности вероятности, т. е. определяет вероятность нахождения частицы в единичном объеме в окрестности точки с координатами х, у, z. Таким образом, физический смысл имеет не сама Y-функция, а квадрат ее модуля |Y|2, которым задается интенсивность волн де Бройля.
Вероятность найти частицу в момент времени t в конечном объеме V, согласно теореме сложения вероятностей, равна
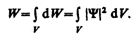
Так как |Y|2d V определяется как вероятность, то необходимо волновую функцию Y нормировать так, чтобы вероятность достоверного события обращалась в единицу, если за объем V принять бесконечный объем всего пространства. Это означает, что при данном условии частица должна находиться где-то в пространстве. Следовательно, условие нормировки вероятностей
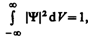 (216.3)
(216.3)
где данный интеграл (216.3) вычисляется по всему бесконечному пространству, т. е. по координатам х, у, z от –¥ до ¥. Таким образом, условие (216.3) говорит об объективном существовании частицы в пространстве.
Чтобы волновая функция являлась объективной характеристикой состояния микрочастиц, она должна удовлетворять ряду ограничительных условий. Функция Y, характеризующая вероятность обнаружения действия микрочастицы в элементе объема, должна быть конечной (вероятность не может быть больше единицы), однозначной (вероятность не может быть неоднозначной величиной) и непрерывной (вероятность не может изменяться скачком).
Волновая функция удовлетворяет принципу суперпозиции: если система может находиться в различных состояниях, описываемых волновыми функциями Y1, Y2,..., Y n,... то она также может находиться в состоянии Y, описываемом линейной комбинацией этих функций:
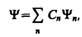
где С n (n =1, 2,...) — произвольные, вообще говоря, комплексные числа. Сложение волновых функций (амплитуд вероятностей), а не вероятностей (определяемых квадратами модулей волновых функций) принципиально отличает квантовую теорию от классической статистической теории, в которой для независимых событий справедлива теорема сложения вероятностей.
Волновая функция Y, являясь основной характеристикой состояния микрообъектов, позволяет в квантовой механике вычислять средние значения физических величин, характеризующих данный микрообъект. Например, среднее расстояние á r ñ электрона от ядра вычисляют по формуле
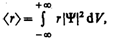
где интегрирование производится, как и в случае (216.3).
- Общее уравнение Шредингера. Уравнение Шредингера для стационарных состояний.
Уравнение Шредингера имеет вид
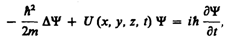 (217.1)
(217.1)
где ћ = h /(2p), т— масса частицы, D—оператор Лапласа 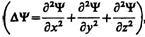 i — мнимая единица, U (х, у, z, t) — потенциальная функция частицы в силовом поле, в котором она движется, Y (х, у, z, t) — искомая волновая функция частицы.
i — мнимая единица, U (х, у, z, t) — потенциальная функция частицы в силовом поле, в котором она движется, Y (х, у, z, t) — искомая волновая функция частицы.
В данном случае решение уравнения Шредингера может быть представлено в виде произведения двух функций, одна из которых есть функция только координат, другая — только времени, причем зависимость от времени выражается множителем 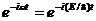 , так что
, так что
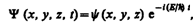 (217.4)
(217.4)
где Е — полная энергия частицы, постоянная в случае стационарного поля. Подставляя (217.4) в (217.1), получим
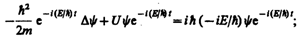
откуда после деления на общий множитель 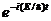 и соответствующих преобразований придем к уравнению, определяющему функцию y:
и соответствующих преобразований придем к уравнению, определяющему функцию y:
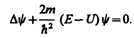 (217.5)
(217.5)
Уравнение (217.5) называется уравнением Шредингера для стационарных состояний.
- Уравнение Шредингера. Решение для потенциальной ямы.
Условие нормировки
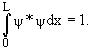
| (3) |
Используя станционарное уравнение Шредингера для случая U = 0, получим
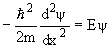
| (4) |
или
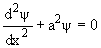 , ,
| (5) |
где
a2 = 2mE/ 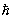 2. 2.
| (6) |
Уравнение (5) описывает положение частицы внутри потенциальной ямы. Оно имеет решение
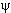 (x) = Ae+iax + Be-iax, (x) = Ae+iax + Be-iax,
| (7) |
представляющее собой суперпозицию двух волн, распространяющихся в противоположных направления вдоль оси x.
- Частица в одномерной бесконечно глубокой прямоугольной потенциальной яме.
Дискретные уровни энергии. Принцип соответствия Бора (предельный переход положений квантовой механики в классические при больших значениях энергетического квантового числа).
По условию задачи (бесконечно высокие «стенки»), частица не проникает за пределы «ямы», поэтому вероятность ее обнаружения (а следовательно, и волновая функция) за пределами «ямы» равна нулю. На границах «ямы» (при х= 0 и х= 1) непрерывная волновая функция также должна обращаться в нуль. Следовательно, граничные условия в данном случае имеют вид
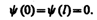 (220.2)
(220.2)
В пределах «ямы» (0 £ х £ l) уравнение Шредингера (220.1) сведется к уравнению
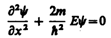
или
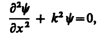 (220.3)
(220.3)
где
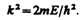 (220.4)
(220.4)
Общее решение дифференциального уравнения (220.3):
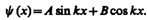
Так как по (220.2) y (0)=0, то В =0. Тогда
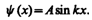 (220.5)
(220.5)
Условие (220.2) y (l) =A sin kl = 0 выполняется только при kl = np, где n — целые числа, т. е. необходимо, чтобы
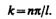 (220.6)
(220.6)
Из выражений (220.4) и (220.6) следует, что
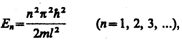 (220.7)
(220.7)
т. е. стационарное уравнение Шредингера, описывающее движение частицы в «потенциальной яме» с бесконечно высокими «стенками», удовлетворяется только при собственных значениях Еn, зависящих от целого числа п. Следовательно, энергия Еn частицы в «потенциальной яме» с бесконечно высокими «стенками» принимает лишь определенные дискретные значения, т.е. квантуется. Квантованные значения энергии Еn называются уровнями энергии, а число п, определяющее энергетические уровни частицы, называется главным квантовым числом. Таким образом, микрочастица в «потенциальной яме» с бесконечно высокими «стенками» может находиться только на определенном энергетическом уровне Еn, или, как говорят, частица находится в квантовом состоянии n.
Подставив в (220.5) значение k из (220.6), найдем собственные функции:
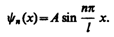
Постоянную интегрирования А найдем из условия нормировки (216.3), которое для данного случая запишется в виде
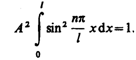
В результате интегрирования получим А = 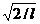 , а собственные функции будут иметь вид
, а собственные функции будут иметь вид
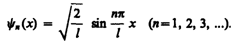 (220.8)
(220.8)
Графики собственных функций (220.8), соответствующие уровням энергии (220.7) при n = 1, 2, 3, приведены на рис. 297, а. На рис. 297, 6 изображена плотность вероятности обнаружения частицы на различных расстояниях от «стенок» ямы, равная | yn (х)|2 = yn (х) y*n (х) для n= 1,2 и 3. Из рисунка следует, что, например, в квантовом состоянии с n =2 частица не может находиться в середине «ямы», в то времякакодинаково часто может пребывать в ее левой и правой частях. Такое поведение частицы указывает на то, что представления о траекториях частицы в квантовой механике несостоятельны.
Из выражения (220.7) вытекает, что энергетический интервал между двумя соседними уровнями равен
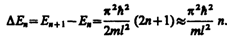
Принцип соответствия Бора: Законы квантовой механики при больших значениях квантовых чисел переходят в законы классической механики.
Вывод из этого принципа: всякая новая теория является развитием предыдущих теорий и полностью её не отвергает, а лишь указывает границы её применимости.
l – орбитальное (побочное или азимутальное) квантовое число. Характеризует (показывает) форму электронного облака и изменяется от 0 до (n-1), то есть, зависит от главного квантового числа. l определяет значение момента количества движения электрона по орбите.
l характеризует число подуровней на заданном энергетическом уровне.
Каждому значению l соответствует орбиталь особой формы.
Орбитали с l = 0 называются s-орбиталями,
l =1 - р-орбиталями (3 типа, отличающихся магнитным квантовым числом m),
l = 2 - d-орбиталями (5 типов),
l = 3 - f-орбиталями (7 типов).
m – магнитное квантовое число. Показывает ориентацию электронного облака в атоме при взаимодействии магнитного поля электрона с внешним магнитным полем и магнитными полями соседних электронов. m определяет число орбиталей на данном подуровне l (от –l до +l).
| n=1 | l=0(s) | m=1 |
| n=2 | l=0(s), 1(p) | m=1,3 m=-1,0,1 |
| n=3 | l=0(s),1(p),2(d) | m=1,3,5 |
Три квантовых числа n, l и m определяют волновые свойства электрона (следует из решения уравнения Шредингера).
s – квантовое число, называемое спин.
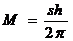
- Прохождение частицы через потенциальный барьер. Туннельный эффект.
Рассмотрим простейший потенциальный барьер прямоугольной формы (рис. 298, а) для одномерного (по оси х) движения частицы. Для потенциального барьера прямоугольной формы высоты U и ширины l можем записать
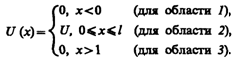
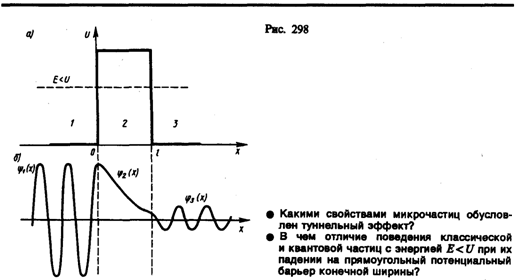
Уравнение Шредингера (217.5) для стационарных состояний для каждой из выделенных на рис. 298, а области имеет вид
 (221.1)
(221.1)
Общие решения этих дифференциальных уравнений:
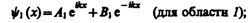 (221.2)
(221.2)
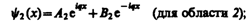
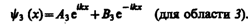 (221.3)
(221.3)
В частности, для области 1 полная волновая функция, согласно (217.4), будет иметь вид
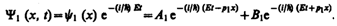 (221.4)
(221.4)
В области 2 решение зависит от соотношений Е>U или Е<U. Физический интерес представляет случай, когда полная энергия частицы меньше высоты потенциального барьера, поскольку при Е<U законы классической физика однозначно не разрешают частице проникнуть сквозь барьер. В данном случае, согласно (221.1), q=ib — мнимое число, где
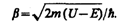
Учитывая значение q и B 3=0, получим решения уравнения Шредингера для трех областей в следующем виде:
 (221.5)
(221.5)
Для описания туннельного эффекта используют понятие коэффициента прозрачности D потенциального барьера, определяемого как отношение плотности потока прошедших частиц к плотности потока падающих. Можно показать, что
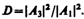
Для того чтобы найти отношение | А 3 /А 1|2, необходимо воспользоваться условиями непрерывности y и y ' на границах барьера х =0 и х = l (рис. 298):
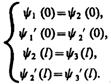 (221.6)
(221.6)
Эти четыре условия дают возможность выразить коэффициенты A 2, A 3, В 1 и В 2 через А 1. Совместное решение уравнений (221.6) для прямоугольного потенциального барьера дает (в предположении, что коэффициент прозрачности мал по сравнению с единицей)
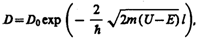 (221.7)
(221.7)
где U — высота потенциального барьера, Е — энергия частицы, l — ширина барьера, D 0 — постоянный множитель, который можно приравнять единице. Из выражения (221.7) следует, что D сильно зависит от массы т частицы, ширины l барьера и от (U—E); чем шире барьер, тем меньше вероятность прохождения сквозь него частицы.
Для потенциального барьера произвольной формы (рис. 299), удовлетворяющей условиям так называемого квазиклассического приближения (достаточно гладкая форма кривой), имеем
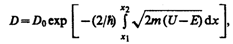
где U = U (x).
- Квантовый гармонический осциллятор. Уравнение Шредингера. Собственные значения энергии. Основное и возбужденные состояния.
Линейный гармонический осциллятор — система, совершающая одномерное движение под действием квазиупругой силы, — является моделью, используемой во многих задачах классической и квантовой теории. Пружинный, физический и математический маятники — примеры классических гармонических осцилляторов. Потенциальная энергия гармонического осциллятора (см. (141.5)) равна
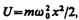 (222.1)
(222.1)
где w 0 — собственная частота колебаний осциллятора, т — масса частицы. Зависимость (222.1) имеет вид параболы (рис. 300), т. е. «потенциальная яма» в данном случае является параболической.

армонический осциллятор в квантовой механике — квантовый осциллятор — описывается уравнением Шредингера (217.5), учитывающим выражение (222.1) для потенциальной энергии. Тогда стационарные состояния квантового осциллятора определяются уравнением Шредингера вида
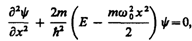 (222.2)
(222.2)
где Е — полная энергия осциллятора. В теории дифференциальных уравнений доказывается, что уравнение (222.2) решается только при собственных значениях энергии
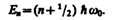 (222.3)
(222.3)
Собственные значения энергии. Рассмотрим систему, состоящую из электрона е, который движется в кулоновском поле неподвижного ядра с зарядом Ze (водородоподобная система). Потенциальная энергия взаимодействия электрона с ядром в такой системе равна
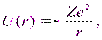
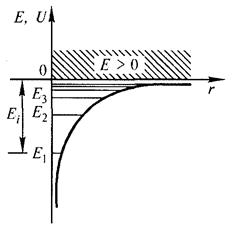
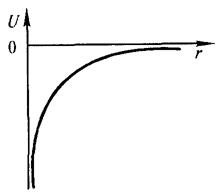
| (13.1) |
где r — расстояние между электроном и ядром, которое в первом приближении будем считать точечным. Графически функция U(r) изображена жирной кривой на рис. 13.1 а. U(r) с уменьшением r (при приближении электрона к ядру) неограниченно убывает. Уравнение Шрёдингера в этом случае имеет вид
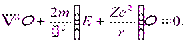
| (13.2) |
Поле (13.1), в котором движется электрон, является центрально-симметричным, т. е. зависит только от r. Поэтому решение уравнения (13.2) наиболее целесообразно проводить в сферической системе координат r,θ,φ, где оператор Лапласа 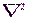 имеет следующий вид:
имеет следующий вид:
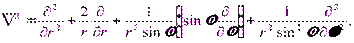
|
Первый случай соответствует свободному электрону (заштрихованная область на рис. 13.1 б), второй — получаемым из уравнения Шредингера собственным значениям энергии
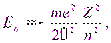 n = 1, 2, 3, … n = 1, 2, 3, …
| (13.4) |
Таким образом, решение уравнения Шредингера приводит для атома водорода к появлению дискретных энергетических уровней Е 1, Е 2,..., Еп, показанных на рис. 13.1 б в виде горизонтальных прямых.
а) б)
Рис. 13.1. а - потенциальная энергия U (r) и б - собственные значения энергии Е электрона в атоме водорода.
Самый нижний уровень Е 1, отвечающий минимальной возможной энергии, — основной, все остальные (Еп > Е 1, п = 2, 3,...) — возбужденные. При Е < 0 движение электрона является связанным — он находится внутри гиперболической потенциальной ямы. Из рисунка следует, что по мере роста главного квантового числа п энергетические уровни располагаются теснее и при п → ∞ Е∞ → 0.
- Атом водорода. Уравнение Шредингера. Собственные значения энергии. Квантовые числа. Вырожденные состояния (состояния с одной энергией и разными другими квантовыми числами, в частности, спиновыми).
Единственный электрон атома водорода находится в состоянии 1 s, характеризуемом квантовыми числами п= 1, l= 0, ml =0 и ms =± ½; (ориентация его спина произвольна).
Собственные функции уравнения (13.2), т. е. ψ -функции, содержат, как выяснилось, три целочисленных параметра — п, ℓ, т:
| ψ = ψnℓ m(r θ,φ), | (13.5) |
где п называют главным квантовым числом (это то же п, что и в выражении для Еп). Параметры же ℓ и m — это орбитальное (азимутальное) и магнитное квантовые числа, определяющие по формулам (12.58) и (12.59) модуль момента импульса М и его проекцию Мг. В процессе решения выясняется, что решения, удовлетворяющие естественным условиям, получаются лишь при значениях ℓ, не превышающих (п – 1). Таким образом, при данном п квантовое число ℓ может принимать п значений:
| ℓ = 0, 1, 2, …, n – 1. | (13.6) |
В свою очередь, при данном ℓ квантовое число т согласно (12.59) может принимать 2ℓ + 1 различных значений:
| т = 0, ±1, ±2,...,± ℓ | (13.7) |
Энергия Еп электрона (13.4) зависит только от главного квантового числа п. Отсюда следует, что каждому собственному значению Еп (кроме случая п = 1) соответствует несколько собственных функций ψnℓ m, отличающихся значениями квантовых чисел ℓ и т. Это означает, что электрон может иметь одно и то же значение энергии, находясь в нескольких различных состояниях. Например, энергией Е2 (п = 2) обладают четыре состояния: ψ 200, ψ 21-1, ψ 210, ψ 21+1.
Состояния с одинаковой энергией называют вырожденными, а число различных состояний с определенным значением энергии Еп - кратностью вырождения данного энергетического уровня. Кратность вырождения n -го уровня водородоподобной системы можно определить, учитывая число возможных значений ℓ и т. Каждому из п значений квантового числа ℓ соответствует 2ℓ + 1 значений т. Поэтому полное число N различных состояний для данного п равно
N = 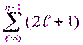 = 1 + 3 + 5 +... + (2п - 1)= п2. = 1 + 3 + 5 +... + (2п - 1)= п2.
| (13.8) |
Как будет показано в дальнейшем, это число надо удвоить из-за наличия собственного момента (спина) у электрона. Таким образом, кратность вырождения n -го энергетического уровня
| N = 2п2. | (13.9) |
- Принцип Паули. Распределение электронов в атоме по состояниям. Периодическая система элементов Менделеева (заполнение оболочек электронами).
Если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки частиц. Отсюда следует, что два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, т.к. для фермионов волновая функция должна быть антисимметричной. Обобщая опытные данные, В. Паули сформировал принциписключения, согласно которому системы фермионов встречаются в природе только в состояниях, описываемых антисимметричными волновыми функциями (квантово-механическая формулировка принципа Паули).
Из этого положения вытекает более простая формулировка принципа Паули, которая и была введена им в квантовую теорию (1925) еще до построения квантовой механики: в системе одинаковых фермионов любые два из них не могут одновременно находиться в одном и том же состоянии. Отметим, что число однотипных бозонов, находящихся в одном и том же состоянии, не лимитируется.
Напомним, что состояние электрона в атоме однозначно определяется набором четырех квантовых чисел:

Распределение электронов в атоме подчиняется принципу Паули, который может быть использован в его простейшей формулировке: в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел п, l, ml и тs т. е.
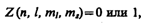
где Z (п, l, ml, тs) — число электронов, находящихся в квантовом состоянии, описываемом набором четырех квантовых чисел: п, l, ml, тs. Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
Согласно формуле (223.8), данному n соответствует n 2 различных состояний, отличающихся значениями l и ml. Квантовое число тs может принимать лишь два значения (± ½). Поэтому максимальное число электронов, находящихся в состояниях, определяемых данным главным квантовым числом, равно
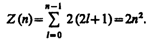
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называют электронной оболочкой. В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l. Поскольку орбитальное квантовое число принимает значения от 0 до n –1, число подоболочек равно порядковому номеру n оболочки. Количество электронов в подоболочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в подоболочке с данным l равно 2(2 l +1).
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делят на четыре типа (семейства).
1. s-Элементы: заполняется электронами s-подуровень внешнего уровня. К ним относятся первые два элемента каждого периода.
2. р-Элементы: заполняется электронами р-подуровень внешнего уровня. Это последние 6 элементов каждого периода (кроме первого и седьмого).
3. d-Элементы: заполняется электронами d-подуровень второго снаружи уровня, а на внешнем уровне остается один или два эле трона (у Pd — нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s- и р-элементами (их также называют переходными элементами).
4. f-Элементы: заполняется электронами f-подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Это лантаноиды и актиноиды.
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 502; Нарушение авторских прав?; Мы поможем в написании вашей работы!