
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второй закон термодинамики. Cамопроизвольные и несамопроизвольные процессы
|
|
|
|
Cамопроизвольные и несамопроизвольные процессы
Тепловые эффекты реакции
В зависимости от типа реакций различают тепловые эффекты:
Теплота образования вещества – тепловой эффект образования 1 моля сложного вещества из простых.
C + O2 = CO2 ΔН0298 CO2 (г) = -393.513 кдж/моль
Теплота разложения вещества - тепловой эффект разложения 1 моля сложного вещества на простые вещества:
СО2 = C + O2 ΔН р-ции = + 393.513 кдж/моль
Теплота сгорания вещества – тепловой эффект реакции взаимодействия вещества с кислородом до образования продуктов полного окисления.
СН3СООН+ О2 = СО2 + Н2О ΔН сгор = 209,4 ккал/моль
Различают также теплоту растворения – тепловой эффект или количество тепла, которое выделяется или поглощается при растворения 1 моля вещества в таком же количестве растворителя и теплоту нейтрализации – количество тепла, которое выделяется или поглощается при нейтрализации 1 г-экв. кислоты 1 г-экв основания.
Закон сохранения энергии утверждает, что количество энергии при любых превращениях остается неизменным. Но он ничего не говорит о том, какие превращения возможны. Между тем, многие процессы, вполне допустимые с точки зрения закона сохранения энергии, никогда не протекают в действительности. Примеры необратимых (однонаправленных) процессов: Нагретые тела остывают, передавая свою энергию более холодным окружающим телам. Обратный процесс передачи тепла от холодного тела к горячему не противоречит закону сохранения энергии, но такой процесс самопроизвольно никогда не происходит. Другой пример: затухание колебаний маятника.
Все эти примеры говорят о том, что процессы в природе имеют определенную направленность, никак не отраженную в первом законе термодинамики. Другими словами, все макроскопические процессы в природе протекают только в одном направлении и. В обратном направлении они самопроизвольно протекать не могут. Все процессы в природе необратимы. Самые трагические из них – старение и смерть организма.
Необратимыми называются процессы, которые могут самопроизвольно протекать только в одном определенном направлении; в обратном направлении они могут протекать как одно из звеньев более сложного процесса. Так например можно увеличить число колебаний маятника, подтолкнув его рукой. – т.е. нужны внешние силы, приложение работы над системой.
Второй закон термодинамики указывает направление возможных энергетических превращений и тем самым выражает необратимость процессов в природе. Нем. ученый Р. Клаузиус сформулировал второй закон термодинамики так: Невозможно перевести теплоту от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или окружающих телах.
Самопроизвольные или положительные процессы – процессы, идущие без затраты работы, энергии извне. В результате совершается работа против внешних сил. Равновесие.
Несамопроизвольные или отрицательные процессы не идут сами собой, для проведения необходимо затратить работу в количестве пропорциональном происходящему изменению.
2 закон термодинамики устанавливает некоторые общие критерии самопроизвольного или несамопроизвольного процессов, а также критерии равновесия, т.е. указывает вероятность протекания процесса: В изолированной системе самопроизвольно протекают только те процессы, при которых энергия переходит от более высокого уровня к более низкому.
Формулировки второго закона:
1. Теплота не может переходить сама собой от более холодного тела к более теплому (Ломоносов).
2. Невозможен круговой процесс, единственным результатом которого является превращение тепла в работу.
3. Нельзя построить машину, которая, превращая тепло в работу, пользовалась бы теплом от некоторого источника и работала бы только при одной температуре этого источника.
Тепло превращается в работу в тепловых машинах. Они осуществляют работу за счет превращения тепла от источника - нагревателя. Но не все тепло нагревателя может быть превращено в работу. Некоторая часть тепла обязательно переходит к телу с более низкой температурой – холодильнику. Работа производится за счет разности температур нагревателя и холодильника:
A = Q1 – Q2, где
Q1 – тепло, полученное машиной от нагревателя
Q2 – тепло, отданной машиной холодильнику.
Принципиальная схема тепловой машины:
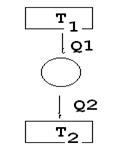
| Т1 – температура нагревателя Тепловой двигатель Т2 – температура холодильника |
Отношение работы, произведенной машиной к величине тепла, полученного от нагревателя, называется термодинамическим коэффициентом полезного действия – КПД машины:
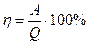
Математическая формулировка второго закона: Нельзя достичь 100% КПД, но чем больше разность температур нагревателя и холодильника, тем выше КПД:

|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 820; Нарушение авторских прав?; Мы поможем в написании вашей работы!