
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Цикл Карно. Работа в тепловых машинах (двигатели внутреннего сгорания) осуществляется за счет круговых процессов (циклов)
|
|
|
|
Работа в тепловых машинах (двигатели внутреннего сгорания) осуществляется за счет круговых процессов (циклов), в которых рабочее тело (газ) получив тепло и совершив работу, возвращается в исходное состояние.
Рассмотрим работу идеальной паровой машины, в которой рабочим телом является 1 моль идеального газа. Цикл такой машины состоит из 4 стадий - процессов: изотермического расширения, адиабатического расширения, изотермического сжатия, адиабатического сжатия. Графически это можно представить как 2 изотермы и 2 адиабаты идеального газа. Все процессы проводятся обратимо.
1 стадия - изотермическое расширение: Газ имеет параметры Р1,V1, Т1. Газ приводится в соприкосновение с нагревателем, имеющим такую же температуру. В результате тепло, поступаемое от нагревателя, не расходуется на повышение внутренней энергии, не теряется зря за счет равенства температур нагревателя и рабочего тела, а расходуется только на совершение работы – работы расширения.
P1,V1,T1 → P2,V2,T1

Тепло, полученное системой, идет на совершение работы:
Q1 = A1 = RT1ln V2/V1
2 стадия – адиабатическое расширение: Рабочее тело изолируется от источника, тепло не поступает и не уходит из системы – т.е. без теплообмена, так называемый адиабатический процесс. При этом газ продолжает расширяться. Работа по расширению газа происходит за счет резервов внутренней энергии газа.
А = - ΔU
Внутренняя энергия газа при адиабатическом расширении уменьшается и рабочее тело охлаждается до температуры Т2.
P2,V2,T1 → P3,V3,T2
При адиабатических процессах:
А2 = - ΔU = - СV (T1-T2)
3 стадия – изотермическое сжатие: Рабочее тело подается в холодильник, который имеет такую же температуру - Т2. Опять достигается экономия: теплота не растрачивается зря, т.к. нет переноса тепла, связанного с разностью их температур. Тем не менее. Рабочее тело отдает некоторое количество теплоты Q2 холодильнику, вследствие чего уменьшается объем рабочего тела до V4, газ сжимается.
P3,V3,T2 → P4,V4,T2
Процесс сжатия тела необходим для обеспечения цикличности работы машины. Т.к. процесс изотермический, работа равна:
А3 = - Q3 = RT2lnV4/V3
4 стадия – адиабатическое сжатие: На четвертой стадии рабочее тело отсоединяют от холодильника, изолируют от внешней среды: газ адиабатически сжимается до первоначального объема. При этом газ нагревается (внутренняя энергия увеличивается) до температуры Т1. P4,V4,T2 → P1,V1,T1
Работа адиабатического процесса:
А4 = ΔU = - СV (T1-T2)
Общая работа тепловой машины равна сумме работ на каждой стадии: А = А1 + А3 = Q1 – Q2
Отсюда:
А = RT1lnV2/V1 - RT2lnV4/V3
Преобразуем уравнение, с учетом, что V2/V1 =V4/V3:
А = R (T2 – T1) ln V2/V1 = Q1 – Q2

После сокращением получаем:
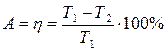
Отсюда еще одна формулировка второго закона термодинамики:
КПД теплового двигателя, работающего по циклу Карно не зависит от природы рабочего газа, а зависит от разности температур нагревателя и холодильника и не может быть равным 100%: вечный двигатель второго рода невозможен.
Все виды энергии могут целиком превращаться в теплоту. Обратный полный переход тепловой энергии в механическую работу невозможен. КПД тепловых двигателей всегда меньше 100%. В этом отношении самыми производительными (КПД = 96%) являются электродвигатели, т.к. электрическая энергия – энергия упорядоченного движения потока электронов, а тепловая энергия – энергия хаотического движения молекул. Само собой беспорядочное движение не может перейти в упорядоченное, поэтому тепловая энергия не может быть полностью превращена в другие виды энергии. Для сравнения: механическая энергия – энергия тоже упорядоченного движения тел.
Все материальные системы обнаруживают тенденцию к достижению максимального беспорядка. Так необратимость процессов характеризуется более вероятностным переходом от порядка к беспорядку, можно ввести количественную меру беспорядка системы – энтропию. Энтропия является функцией определяющей возможность протекания самопроизвольного процесса в изолированной системе
Энтропия (S) - функция состояния, характеризующая меру превращаемости тепла в работу, зависит от температуры и давления.
Второй закон термодинамики через энтропию: В изолированных системах, в которых возможны самопроизвольные или необратимые процессы, энтропия не может уменьшаться (dS > 0). В этой формулировке заключен критерий самопроизвольности протекания процесса в изолированной системе.
Являясь мерой необратимости процесса энтропия прямо пропорциональна теплоте и обратно пропорциональна температуре:
Мерой превращаемости тепла в работу является функция состояния, зависящая от температуры и давления. Клаузиус (1865 г) предложил назвать эту функцию энтропия - S (от греческого – превращение).
Также как внутренняя энергия и энтальпия энтропия является характеристикой системы, ее функцией состояния. Ее нельзя полностью измерить, и судят только об изменении – ΔS.
Энтропия является количественной мерой беспорядка системы. Единица измерения: ккал/моль*град.
Н2О тв → Н2Ож ΔS = 30.6 ккал/моль*град
Значение энтропии зависит не только от агрегатного состояния вещества, но и от сложности молекул:
SCO2 > SCO ΔS = 16.2 Э.е.
Являясь мерой необратимости процесса энтропия прямо пропорциональна теплоте и обратно пропорциональна температуре:

Изменение энтропии в процессе равно отношению теплового эффекта и абсолютной температуры.
Если процессы протекают 1) самопроизвольно, то 
2) в состоянии равновесия 
3) в несамопроизвоьных процессах 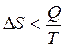
Второй закон термодинамики через энтопию: В изолированных системах, в которых возможны самопроизвольные или необратимые процессы энтропия не может уменьшаться:
dS > 0
В этой формулировке заключен критерий самопроизвольности протекания процесса в изолированной системе.
Термодинамические потенциалы
Вспомним уравнение первого закона термодинамики:
ΔQ = ΔU + ΔA
Подставив Q =TΔS, получим
TΔS = ΔU + ΔA
Или ΔU = TΔS – ΔA
Рассматривая это уравнение можно заключить, что внутренняя энергия состоит из двух частей. Первая часть – произведенная работа. Эта работа производится системой за счет энергии, которую называют свободной энергией или изобарно-изотермическим потенциалом. В химических процессах протекают одновременно два противоположных процесса: стремление частиц объединиться – что приводит к уменьшению энтропии системы, и стремление частиц к разъединению – увеличение энтропии. Суммарный эффект этих тенденций, протекающих при постоянных температуре и давлении, и отражается в изобарно-изотермическом потенциале или энергии Гибса - ΔG:
ΔG = ΔH – TΔS
В случае изохорно-изотермических процессов T,V =const свободную энергию изохорно-изотермическим потенциалом или энергией Гельмгольца - ΔF:
ΔF = T ΔS - ΔU
Вторая часть внутренней энергии связана с теплотой. Она не переходит в работу, а всегда остается в виде тепла – TΔS. Это связанная энергия – энтропийный фактор. TΔS показывает какое количество теплоты бесполезно рассеяно в самом совершенном двигателе – связанная энергия.
Т.е. по характеру изменений термодинамических функций и энтропии мы можем ответить на вопросы:
1)о принципиальной возможности процесса
2) о направленности процесса
Общий вывод:
1) Если dF < 0, dG < 0, то в системе возможен самопроизвольный процесс без затраты работы и энергии извне. Химическая реакция в этом случае протекает только в одном – прямом направлении.
2) dF > 0, dG > 0 – в этом случае самопроизвольный процесс принципиально невозможен. Химическая реакция в прямом направлении протекает только за счет получения энергии, работы извне.
3) dF = 0, dG = 0 – в этом случае система находится в состоянии равновесия, которое является пределом самопроизвольности процесса при T, P, V = const.
|
|
|
|
|
Дата добавления: 2015-05-09; Просмотров: 779; Нарушение авторских прав?; Мы поможем в написании вашей работы!