
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамика биологических процессов
|
|
|
|
Биологические организмы как объекты исследования термодинамики имеют несколько специфических особенностей. Все биологические системы являются открытыми. То есть они обмениваются веществом и энергией с окружающим миром. Вторая особенность—они относятся к сфере исследований сильно неравновесных систем, что означает их независимость от внешних воздействий, что в биологии называют гомеостазом, а также нелинейное поведение процессов в этих системах, объяснить которые основные законы термодинамики не способны.
Термодинамика рассматривает общие закономерности превращения энергии в форме тепла и работы между телами. В открытых биологических системах постоянно происходит процесс обмена энергией с внешней средой. Внутренние метаболические процессы также сопровождаются превращениями одних форм энергии в другие. Достаточно напомнить о механических процессах, трансформации энергии кванта света в энергию электронного возбуждения молекул пигментов, а затем в энергию химических связей восстановленных соединений в фотосинтезе. Другой пример - преобразование энергии электрохимического трансмембранного потенциала в энергию АТФ в биологических мембранах.
Механизмы трансформации энергии в биоструктурах связаны с конформационными превращениями особых макромолекулярных комплексов, таких, как реакционные центры фотосинтеза, Н-АТФаза хлоропластов и митохондрий, бактериородопсин. Однако помимо выяснения детального характера происходящих здесь процессов особый интерес представляют общие характеристики эффективности преобразования энергии в таких макромолекулярных машинах.
Как известно из биологии, получение свободной энергии из продуктов питания и ее потребление для обеспечения жизнедеятельности живыми организмами осуществляется с помощью метаболизма – циклов обмена веществ, непрерывно происходящих в их клетках, и представляющих собой комплексы разнообразных биохимических реакций расщепления и синтеза веществ различными метаболическими путями.
Поскольку обмен веществ происходит циклами, то в клетках, в соответствии с этими циклами, происходят непрерывные периодические изменения концентраций веществ, участвующих в многочисленных биохимических реакциях.
Среди всех биохимических реакций особую роль играют реакции синтеза из молекул углеводов и жиров, содержащихся в питательных веществах, аденозинтрифосфата (АТФ), и его последующего расщепления, в результате чего выделяется энергия. Структура АТФ показана на рис.1.
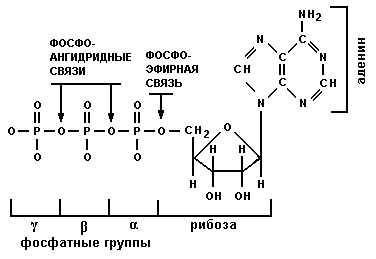
Рис.1. Структура АТФ
Как видно из рис.1, АТФ состоит из трех фосфатных групп, остатков азотистого основания аденина) и остатка сахара (рибозы). При разрыве фосфоангидридных и фосфоэфирной связей выделяется энергия.
Фосфатные группы могут быть постадийно отщеплены путем растворения в воде гидролиза) и образования ортофосфата или неорганического фосфата и аденозиндифосфата АДФ, а затем, после расщепления АДФ, и аденозинмонофосфата с выделением энергии на каждой стадии:
АТФ + Н2О→ АДФ + Фн + H+ + ΔG = -30 кДж/моль
АДФ + Н2О→АМФ + Фн + H+ + ΔG = -30 кДж/моль
АМФ + Н2О→аденозин + Фн + H+ + ΔG = -13 кДж/моль
Здесь: Фн - неорганический фосфат;
H+ - положительный ион водорода;
ΔG - изменение свободной энергии, выделяемой при отрыве концевой фосфатной группы.
Обычно клетки извлекают энергию из АТФ во время клеточного дыхания, отщепляя от его молекулы только одну фосфатную группу.
На рис.2 приведен пример упрощенного графика циклов синтеза-расщепления АТФ.

Рис.2. Упрощенный график синтеза-расщепления АТФ.
U - количество АТФ в клетке; I – процесс синтеза; П – процесс расщепления.
Как видно из графика на рис.2, изображенные на нем процессы синтеза АТФ (кривая I), и расщепления АТФ (кривая II) по своей форме близки к экспонентам.
Верхние и нижние границы концентрации биохимических веществ U max и U min определяются соответствующими положительной и отрицательной обратными связями, имеющимися в живых системах.
Скорость протекания биохимических реакций регулируется соответствующими биохимическими катализаторами, ускоряющими эти реакции, и ингибиторами.
Аналогично происходят групповые когерентные биохимические реакции на уровне органов, систем и организмов в целом.
Таким образом, эти термодинамические колебания потребления и выделения энергии и являются механизмом обеспечения устойчивого неравновесного термодинамического состояния.
Величина устойчивости неравновесного термодинамического состояния определяется параметрами механизмов регуляции ферментативных реакций и биологическими свойствами организма.
Датчиками, определяющими скорость и характер метаболических процессов, в живых организмах являются аллостерические модуляторы и гормоны, непрерывно контролирующие термодинамическое состояние организма.
Устойчивость неравновесного термодинамического состояния биологических систем обеспечивается следующим образом:
o при минимальном значении неравновесного термодинамического состояния клеток, органов и целостного организма, например температуры, датчики включают режим расщепления АТФ, в результате чего энергетика организма (его температура) начинает возрастать, достигая некоторого максимального значения;
o при максимальном значении неравновесного термодинамического состояния клеток, органов и целостного организма (температуре) датчики включают режим синтеза АТФ, при котором энергетика организма (температура) начинает уменьшаться.
Отсюда видно, что неравновесное термодинамическое состояния организма всегда непрерывно колеблется в определенных пределах, обеспечивая тем самым устойчивость этого состояния.
В этом также нетрудно убедиться на примере частично управляемой физиологической функции организма – дыхании, при котором в одной фазе – вдохе - обеспечивается снабжение организма кислородом, в при другой фазе – выдохе – удаляется углекислый газ. Процессы вдоха и выдоха непрерывно регулируются. В спокойном состоянии глубина дыхания незначительная, а его частота – низкая. Однако при интенсивной работе значительно возрастает как глубина дыхания, так и его частота. Отсюда видно, что в зависимости от нагрузки эта физиологическая функция, совместно с другими, оперативно изменяет свои параметры для сохранения устойчивого неравновесного термодинамического состояния организма при изменившихся условиях.
Из этого следует биологические системы подчиняются закону Доброборского, излагаемому в следующей редакции:
Закон Доброборского
Устойчивость неравновесного термодинамического состояния биологических систем обеспечивается непрерывным чередованием фаз потребления и выделения энергии посредством управляемых реакций синтеза и расщепления АТФ
Из этого закона вытекают следующие следствия:
1. В живых организмах ни один процесс не может происходить непрерывно, а должен чередоваться с противоположно направленным: вдох с выдохом, работа с отдыхом, бодрствование со сном, синтез с расщеплением и т.д.
2. Состояние живого организма никогда не бывает статическим, а все его физиологические и энергетические параметры всегда находятся в состоянии непрерывных колебаний относительно средних значений как по частоте, так и по амплитуде.
3. «ВСЕОБЩИЙ ЗАКОН БИОЛОГИИ» БАУЭРА
Наряду с теоретическими работами физиков над проблемами законов термодинамики, этой же проблемой, но применительно к биологии, в начале 20-го века занимался биолог-теоретик Эрвин Симонович Бауэр.
В то время биология как наука еще не была достаточно развита. Еще не был известен состав клеток и их основные функции, и было общепринятым считать, что жизнь—это некоторое вещество с особыми свойствами.
В микроскоп живое вещество различных живых организмов выглядело практически одинаково в виде клеток с желеобразной массой (которая получила название протоплазма).
Основной задачей, которую поставил перед собой Э. Бауэр—определить основные термодинамические свойства живых веществ, за которое он принимал молекулы белков в особом, неравновесном состоянии.
Несмотря на целый ряд ошибочных предположений, принципиальным научным достижением Э. Бауэра в этой работе является неопровержимое доказательство того, что живые организмы могут находиться только в устойчивом неравновесном термодинамическом состоянии. Э. Бауэром был сформулирован «Всеобщий закон биологии» в следующей редакции:
| «Все и только живые системы никогда не бывают в равновесии и исполняют за счет своей свободной энергии постоянную работу против равновесия, требуемого законами физики и химии при существующих внешних условиях». |
По существу этот закон является Первым законом термодинамики биологических систем.
Э. Бауэром также был сформулирован «Принцип устойчивого неравновесия живых систем»:
| «Для живых систем характерно именно то, что они за счет своей свободной энергии производят работу против ожидаемого равновесия». |
Позже теория Э. Бауэра была полностью подтверждена работами И. Пригожина, Г. Хакена и Р. Тома. Как утверждает И. Пригожин: «…и биосфера в целом, и ее различные компоненты, живые или неживые, существуют в сильно неравновесных условиях. В этом смысле жизнь, заведомо укладывающаяся в рамки естественного порядка, предстает перед нами как высшее проявление происходящих в природе процессов самоорганизации».
4. СООТНОШЕНИЕ Л. ОНЗАГЕРА И ТЕОРЕМА И. ПРИГОЖИНА
В классической термодинамике рассматриваются главным образом равновесные состояния системы, в которых параметры не изменяются во времени. Однако в открытых системах реакции и соответствующие энергетические превращения происходят постоянно, и поэтому здесь необходимо знать скорости трансформации энергии в каждый момент времени. Это значит, что в энергетических расчетах надо учитывать и фактор времени. Для этого необходимо каким-то образом сочетать термодинамический и кинетический подходы в описании свойств открытой системы.
|
|
|
|
|
Дата добавления: 2015-05-10; Просмотров: 1582; Нарушение авторских прав?; Мы поможем в написании вашей работы!