
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Діаграми стану двохкомпонентних сплавів
|
|
|
|
Поняття про фазові діаграми розчинів.
Емульсії як рідинні системи
Полімерні емульгатори
Температура обертання фаз
Температура обертання є особливістю емульсій, отриманих за допомогою неіоногенних емульгаторів. Переведення ліпофільної емульсії (типу «вода в олії») в гідрофільну (типу «олія у воді») або навпаки називають обертанням фаз. Таке обертання можливе при зміні температури. Це пояснюється тим, що етоксильовані неіонні емульгатори залежно від температури змінюють свої гідрофільно-ліпофільні властивості, а саме — значення ГЛБ.
Як і низькомолекулярні ПАР, полімери теж можуть сприяти утворенню емульсій, якщо вони мають достатньо високу поверхневу активність.
Прикладами природних полімерних емульгаторів є протеїни (білки), та їхні похідні; ефіри целюлози та природні полісахариди, наприклад гуміарабік.
Емульсії — це рідинні дисперсні системи, які не мають межі текучості. Зовнішня (або безперервна) фаза, яка зветься також дисперсійним середовищем, містить у собі одну або декілька внутрішніх, дисперсних фаз рідких і/або рідкокристалічних.
Розміри частинок дисперсної фази знаходяться в грубодис персному діапазоні від 1 до 40 мкм. Якщо обидві фази мають різний показник заломлення, то такі емульсії мають вигляд непрозорих, білих рідин (приклад — молоко). Як і всі дисперсні системи, емульсії мають вищу в’язкість, ніж в’язкість дисперсного середовища (безперервної фази).
Для стабілізації емульсій вводять емульгатори. Вони й визначають тип емульсії які утворюються — «олія у воді» або «вода в олії».
За правилом Банкрофта, безперервною стає та фаза, в якій емульгатор краще розчинюється.
Емульсії типу «олія у воді» — це рідкі системи, в яких дисперсійна (або зовнішня) фаза — вода, а внутрішня, дисперсна фаза складається із оліє-жирових компонентів. У емульсій типу «вода в олії» дисперсійна, або безперервна, фаза складається із олієподібних компонентів, а дисперсна фаза — із води. Множинними емульсіями називають комплексні системи, в котрих краплі дисперсної фази містять дрібніші крапельки, які ідентичні або схожі на безперервну фазу. Таким чином, множинні емульсії містять, як мінімум, три фази.
Фазовий склад і структуру сплаву в залежності від температури і концентрації в зручній графічній формі показують діаграми стану.
Діаграми стану подвійних систем будують у координатах температура хімічний склад сплаву. Вид діаграми визначається особливостями компонентів, які формують даний сплав і характером їх взаємодії. Діаграми надають інформацію про температури початку і закінчення перетворень сплавів, що, в свою чергу, дозволяє підібрати режим термічної обробки і визначити кінцеву структуру сплаву після охолодження.
Побудова діаграм стану основана на фіксації характерних точок сплаву, що мають місце при його охолодженні. Для чого в сплав (1), що охолоджується поміщається термопара (2) і спеціальним приладом (3) проводиться запис температури в процесі охолодження сплаву. Аналогічний процес проводиться для декількох складів сплаву. При зміні фазового складу сплаву на кривій зниження температури, в залежності від числа ступенів свободи, буде спостерігатися перегин (рис. 4.1.б), або горизонтальна лінія. Відповідні температури, при яких проходять такі зміни наносяться на вертикальну лінію, яка на діаграмі стану показує склад нашого сплаву. Провівши подібні виміри для декількох сплавів різного складу (рис. 4.1.в) та з’єднавши відповідні точки, отримаємо діаграму стану для подвійних сплавів компонентів А і В.

Рис.4.1. Схема процесу побудови діаграм стану.
Однією з найпростіших є діаграма стану систем з необмеженою розчинністю компонентів у рідкому і твердому стані (рис.4.2). Верхню

Рис.4.2. Діаграма стану сплаву необмежений твердий розчин.
криву називають кривою ліквідус. Вище її всі сплави знаходяться в рідкому стані, область існування сплаву в рідкому стані позначають L.
Крива ліквідус показує, як змінюється температура початку кристалізації сплавів в залежності від їх хімічного складу. Нижню криву називають кривою солідус, або кривою кінця кристалізації. Нижче неї всі сплави знаходяться у твердому стані і мають однофазну структуру твердого розчину. В інтервалі температур між кривими ліквідус і солідус, який називається інтервалом кристалізації, усі сплави складаються з двох фаз: рідини і кристалів твердого тіла. Тверді розчини прийнято позначати маленькими грецькими буквами (a, b, g, d). При цьому твердий розчин, що має кристалічну гратку компонента А позначають a, компонента В - b.
При аналізі діаграми стану може виникнути питання про фазовий склад будь-якого сплаву при визначеній температурі, про відносну кількість кожної з фаз, про концентрації в цих фазах компонентів. Відповідь на ці питання, можна одержати за допомогою правила відрізків. Наприклад, для сплаву І-І при температурі, що характеризує т.Д потрібно одержати відповіді на зазначені питання. Через т.Д проводимо відрізок горизонтальної прямої (коноду ) до перетину з лініями діаграми, що обмежують дану область, проекції точок перетину на вісь концентрацій дадуть склад фаз. При цьому склад рідкої фази визначається, проекцією т.С на вісь концентрацій, а склад a-твердого розчину - проекцією т.К. Відносна кількість кожної з фаз визначається співвідношенням довжини відповідних відрізків коноди: 
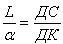 .
.
| Правило відрізків можна використовувати лише в двохфазних областях діаграми. |
.
Структура сплавів при кімнатній температурі буде складатись з кристалів чистих компонентів і евтектики. Для чисто евтектичного сплаву ІІ-ІІ структура буде складатися тільки з зерен евтектики. Розрахунок числа ступенів свободи при побудові кривих охолодження аналогічний вищесказаному за виключенням протікання евтектичного перетворення. С=К–Ф+1, К=2, Ф=3, тому що з рідини (одна фаза) одночасно виділяються два типа кристалів (дві фази), таким чином Ф=1+2=3 і С=2–3+1=0, тобто маємо нонваріантну систему і ні один з факторів (температура, концентрація) не змінюється без зміни числа фаз. На кривій охолодження з’явиться горизонтальна площадка. Після повної кристалізації рідини залишаться тільки дві фази: кристали А і В, С=2–2+1=1 і почнеться зниження температури.
Розглянемо діаграму стану сплаву обмежений твердий розчин. Такі діаграми бувають з евтектичним перетворенням, яке відбувається так, як в сплавах механічна суміш і перитектичним перетворенням. Розглянемо сплав з евтектичним перетворенням. (Рис. 4.4).
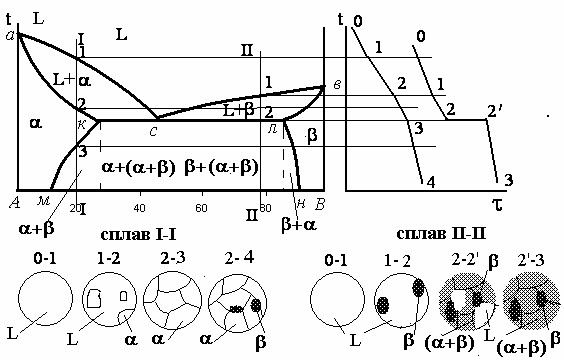 Рис. 4.4. Діаграма стану сплаву обмежений твердий розчин з евтектичним перетворенням.
Рис. 4.4. Діаграма стану сплаву обмежений твердий розчин з евтектичним перетворенням.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 909; Нарушение авторских прав?; Мы поможем в написании вашей работы!