
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные химические законы
|
|
|
|
1.Закон сохранения массы веществ (независимо друг от друга открыт в 1748г. М.В.Ломоносовым и в 1789 г. А.Лавуазье): масса исходных веществ равна массе продуктов реакции.
Поэтому для соблюдения этого закона каждая химическая реакция должна быть уравнена (одинаковое число атомов каждого элемента в левой и правой частях уравнения гарантирует одинаковые массы всех веществ).
2.Закон постоянства состава: всякое чистое вещество независимо от способов его получения имеет постоянный качественный и количественный состав.
Пример:
Вещество «углекислый газ» может быть получено различными способами:
а) С + О2 = СО2;
б) СаСО3 = СаО + СО2;
в) СН4 + 2О2 = СО2 + 2 Н2О;
но во всех случаях состав молекулы один и тот же: 1 атом углерода и 2 атома кислорода.
3.Закон Авогадро: в равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул.
Следствия:
- При нормальных условиях (н.у.) 1 моль любого газа занимает объем
22,4 л (н.у.: Р = 1 атм = 760 мм рт.ст. = 101325 Па; t = 0о С; Т = 273 К).
- Относительная плотность одного газа по другому равна отношению их молярных (М) или относительных молекулярных (Мr) масс.
4.Уравнение Менделеева-Клапейрона – уравнение состояния идеального газа:
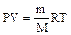 ,
,
где Р – давление газа, Па; V – его объем, м3; m – масса вещества, г;
М – молярная масса вещества, г/моль; Т – абсолютная температура, К;
R – универсальная газовая постоянная, равная 8,314 Дж/(моль* К).
Вопросы для закрепления материала:
1.Определить степени окисления элементов в соединении NH4 MnO4.
2.Рассчитать плотность NO по: а)водороду; б)воздуху; в)кислороду; г)азоту.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 727; Нарушение авторских прав?; Мы поможем в написании вашей работы!