
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Главные подгруппы побочные подгруппы
|
|
|
|
состоят из s- и p-элементов состоят из d-элементов (и f-)
Металлические свойства элементов обусловлены легкостью отдачи электронов (эл-т 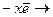 эл-тх+): чем легче атом отдает электроны, тем более активным металлом он будет. Рассмотрим, как меняются металлические свойства в Периодической системе.
эл-тх+): чем легче атом отдает электроны, тем более активным металлом он будет. Рассмотрим, как меняются металлические свойства в Периодической системе.
По периоду слева направо радиус атома уменьшается и растет число валентных электронов, и чем больше их становится, тем труднее их отдача. Следовательно, по периоду слева направо металлические свойства ослабевают.
По группе (берем элементы главных подгрупп, подгрупп А, содержащих s- и p-элементы) сверху вниз число валентных электронов постоянно, но радиус атома увеличивается. И чем дальше расположены валентные электроны от ядра, тем легче их оторвать от атома и тем сильнее металлические свойства. (В побочных подгруппах, т.е. для d-элементов, за исключением 3-Б группы, изменение энергии ионизации носит обратный характер: она увеличивается сверху вниз). Следовательно, самый активный металл в Периодической системе - франций (Fr).
Потенциал ионизации (I, эВ) - та энергия, которую нужно затратить для отрыва электрона от атома. Чем меньше I, тем активнее металл (I минимален у Fr).
Неметаллические свойства элементов обусловлены способностью элементов присоединять к себе электроны (в итоге атомы достраивают свой валентный слой, приобретают отрицательный заряд, а их электронная оболочка становится, как у инертного газа (эл-т 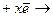 эл-тх-).
эл-тх-).
Неметаллические свойства обратны металлическим.
По периоду слева направо для завершения внешнего электронного слоя до восьми электронов атому нужно принять все меньше электронов, этот процесс осуществляется все легче и неметаллические свойства возрастают.
По группе снизу вверх радиус атома уменьшается, ядро все активнее притягивает к себе недостающие до октета электроны и неметаллические свойства возрастают. Самый активный неметалл в Периодической системе - фтор (F).
Энергия сродства к электрону (Е, эВ) - та энергия, которая выделяется при присоединении электрона к атому. Чем больше Е, тем активнее неметалл (Е максимальна у F).
Вопросы для закрепления материала:
1.У какого элемента (алюминия или галлия) сильнее выражены металлические свойства?
2.Почему элементы ванадий и галлий находятся в разных подгруппах Периодической системы?
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1030; Нарушение авторских прав?; Мы поможем в написании вашей работы!