
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
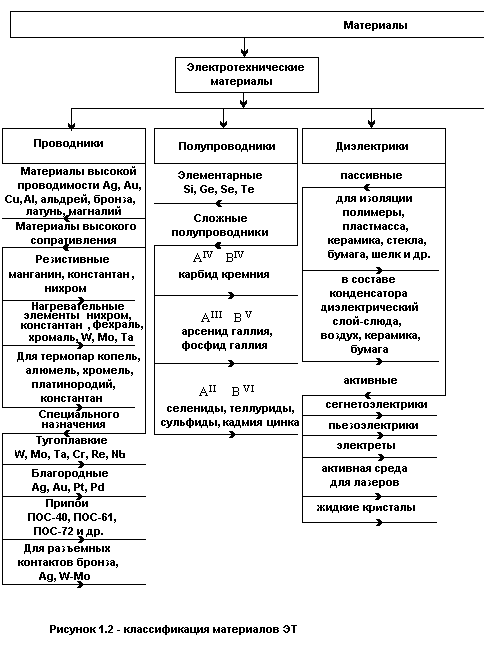
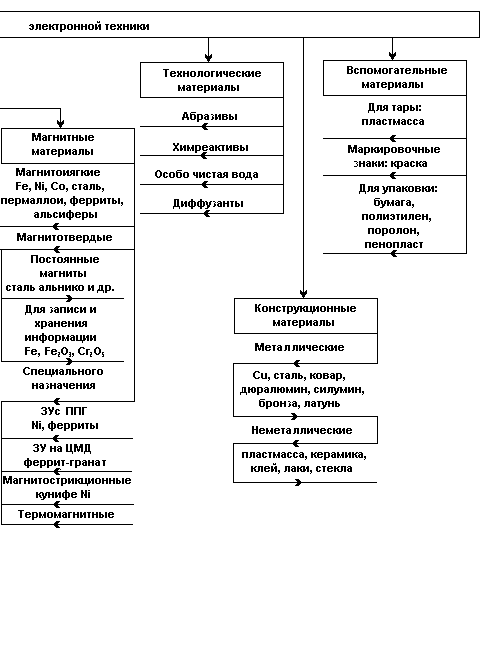
Типы химических связей
|
|
|
|
Все вещества построены из молекул, а молекулы из атомов. Атом состоит из положительно заряженного ядра, вокруг которого вращаются электроны. Каждый электрон испытывает не только притяжение со стороны ядра» но и отталкивание со стороны электронов. Внутренние электронные слои ослабляют притяжение внешних электронов к ядру. Электроны внешнего слоя называются валентными. Они слабее связаны с ядром и могут отрываться от одного атома и присоединяться к другому атому. Атом, лишившись одного или нескольких электронов, становится заряженным положительно, а атом, присоединивший к себе лишние электроны, заряжается отрицательно. Образующиеся заряженные частицы называют ионами. Ионы различных элементов могут соединяться между собой, образуя' молекулы. Молекула - наименьшая частица вещества, определяющая его химические свойства.
Рассмотрим основные виды связей, за счет которых происходит объединение атомов в молекулы.
Ковалентная связь возникает между атомами путем образования общих пар валентных электронов - по одному от каждого атома. Упрощенная схема ковалентной связи в молекуле водорода приведена на рисунке 1.3. Эти пары электронов становятся общими для атомов, входящих в состав молекулы.
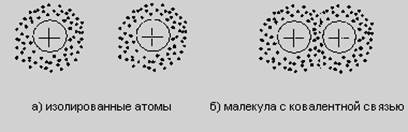
Рисунок 1.3 - Упрощенная схема ковалентной связи в молекуле водорода
Электроны при движении по молекулярной орбите чаще всего находятся между ядрами; где создается как бы избыток отрицательного заряда, что способствует сближению атомов.
Если молекула состоит из одноимённых атомов (H2,N2,O2,Cl2), то электронная пара в одинаковой степени принадлежит обоим атомам. Такую молекулу и существующую в ней ковалентную связь называют неполярной или нейтральной. В неполярных молекулах центры положительных и отрицательных зарядов совпадают. Если же двухатомная молекула состоит из атомов различных элементов, электронная пара может быть смещена к одному из атомов. В этом случае ковалентную связь называют полярной, а молекулы, у которых центры положительных и отрицательных зарядов не совпадают, - полярными или дипольными. Многоатомные молекулы также могут быть неполярными - при симметричном расположении зарядов или полярными - при их асимметричном расположении.
Вещества с ковалентной связью обладают высокой твердостью и хрупкостью. К ним относятся алмаз, кремний, германий, соединения элементов из средних групп таблицы Д.И. Менделеева – SiC,BH. Ковалентные связи характерны и для молекул таких газов, как H2, О2, N2, а также молекул многих органических соединений - полиэтилена (C2 H4), политетрафторэтилена (С2F4)n, и др. (связи между отдельными молекулами этих соединений - молекулярные).
Ионная связь обусловлена кулоновским притяжением противоположно заряженных ионов. Ионная связь менее прочна, чем ковалентная. К веществам с ионной связью относится большинство солей, (Na – Cl, Li -F) и некоторые оксиды (Cu2O, Zn0, CdO, Fe2 O3 и др.)
Молекулярная связь- cвязь между отдельными молекулами за счет электростатического притяжения зарядов с противоположными знаками (сил Ван-дер-Ваальса) Природа этих сил сводится к взаимодействий молекулярных диполей, Диполи молекул ориентируются так, что обращенные друг к другу концы соседних диполей разнополярны, и силы притяжения преобладают над силами отталкивания. Эти связи слабые, поэтому.молекулярная связь разрушается при тепловом движении молекул. Вещества с молекулярной связью имеют низкие температуры плавления и кипения (парафин, нафталин и др.).
Металлическая связь — связь между положительно заряженными ионами металла с помощью обобществленных свободных электронов, которые находятся между ионами. Отсутствием направленности металлической связи объясняется высокая пластичность металлов, а наличие свободных электронов обуславливает высокую электро- и теплопроводность.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1347; Нарушение авторских прав?; Мы поможем в написании вашей работы!