
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Металлические покрытия
|
|
|
|
Под действием влаги или технологических факторов изделия из металлов или сплавов изменяют цвет, внешний вид, механические и электрические свойства и могут приходить в негодность частичную или полную. Это является следствием коррозии, которая разрушает металл или сплав вследствие химического или электрохимического воздействия окружающей среды.
При равномерной коррозии разрушение происходит с одинаковой силой по всей поверхности. Равномерной коррозии подвержены чистые металлы и однофазные сплавы в агрессивных средах.
Местная коррозия представляет собой разрушение поверхности на некоторых участках. Наблюдается при нарушении слоя покрытия.
Интеркристаллитная (межкристаллитная) коррозия – это разрушение материала по зернам.
Различают химическую и электрохимическую коррозию:
Химическая коррозия возникает при воздействии на металл при высокой температуре находящихся в атмосфере газов и паров, а также жидких неэлектролитов (минеральное масло, керосин и др.).
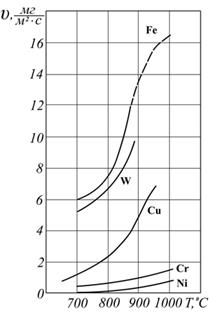
Рисунок 2.4 – Зависимость скорости окисления от температуры для железа, вольфрама, меди, хрома, никеля (на воздухе)
Химическая коррозия – окислительно-восстановительный процесс, при взаимодействии металла (сплава), с газами (О2, СО2, сернистый газ) и жидкостями. Из всех металлов (сплавов) черных, цветных, благородных наиболее сильно подвергаются химической коррозии черные металлы. Fe при повышенной температуре и наличии паров воды окисляется с образованием ржавчины:
4Fe + 2H2O + 3O2 = 2Fe2O3 + H2O
Цветные металлы подвергают коррозии в меньшей степени, а благородные в основном не окисляются, только Ag на воздухе, в котором содержится сероводород чернеет:
4Ag + 2H2S + O2 = 2Ag2S + 2H2O
В результате химической коррозии на поверхности металла (сплава) образуются химические соединения, пленки оксидов, сульфидов, которые могут быть пористыми и сплошными, прочными и непрочными, они не могут защищать поверхность Fe от дальнейшего окисления. Оксидные пленки на поверхности Ni, Сr, Сu, Al, Zn, сплошные, прочные и защищают металл от дальнейшего разрушения.
Химическая коррозия в чистом виде наблюдается редко, чаще протекает электрохимическая коррозия. Она возникает на контакте двух металлов, находящихся в электролите, т.е. жидкости, которая проводит электрический ток (это водные растворы солей, щелочей, кислот). В этом случае образуется гальванический элемент, электродами которого являются металлы, причем возникает электрический ток тем большей силы, чем дальше отстоят друг от друга металлы в ряду активности:
Li, К, Mg, Al, Zn, Сr, Fe, Cd, Co, Ni, Sn, Pb, Cu, Ag, Pt, Au.
Поток электронов движется or более активного в электролите металла к менее активному. Более активный металл, стоящий левее в ряду активности, разрушается. Причем скорость коррозии тем больше, чем дальше в ряду активности стоят друг от друга металлы, образующие гальваническую пару. Например, при возникновении гальванической пары Cu-Pt, разрушается Сu, Cu-Zn, коррозирует Zn.
С точки зрения электрохимической коррозии понятно, что если металле присутствуют дополнительные примеси, то металл ипримеси могут образовывать гальваническую пару и это приведет к разрушению металла. Поэтому, когда требуется очень высокая химическая устойчивость материала, то в первую очередь используют чистые металлы, а не сплавы. Сплавы металлов обладают различной коррозионной стойкостью. Сплавы цветных металлов более коррозионностойкие, чем сплавы черных металлов. Высокими коррозионными свойствами обладает сплавы Ti, Al, и т.д. Коррозия наносит народному хозяйству большой ущерб. Потери Fe от коррозии составляют около 10% от его выплавки. Для сокращения этих потерь применяют различные методы защиты от коррозии. Одним из них является метод нанесения защиты покрытий.
Для защиты от коррозии, обеспечения качества, надежной работы и придания эстетичного внешнего вида на детали радиоэлектронной аппаратуры наносят защитные и декоративные покрытия.
Наибольшее распространение получили металлические, химические и лакокрасочные покрытия.
Металлические покрытия представляют собой тонкий слой металла, нанесенный на поверхность. Металлические покрытия выполняют для защиты от коррозии, получения высокой чистоты поверхности, создания хрупкой пленки на свариваемых поверхностях и улучшения внешнего вида.
К металлическим покрытиям предъявляются следующие основные требования: прочное сцепление с основным металлом; мелкокристаллическая структура, обеспечивающая наилучшие механические свойства; равномерная толщина.
Технологический процесс нанесения металлических покрытий включает в себя следующие основные операции: подготовка поверхности, нанесение покрытий, промывка и сушка.
Перед нанесением покрытия поверхность подвергают:
механической обработке для повышения чистоты поверхности, удаления неровностей и продуктов коррозии;
обезжириванию путем промывки в органических растворителях (керосин, бензин), обработке в извести и горячих растворах щелочей;
декопированию (легкому травлению) путем погружения детали в 5...10%-й раствор серной или соляной кислоты на одну-две минуты для удаления с поверхности детали тонких оксидных пленок и выявления структуры, что способствует лучшему сцеплению металлического покрытия с основным металлом.
Металлические покрытия могут наноситься гальваническим, вакуумным и химическим способами, а также металлизацией.
Гальванические (электролитические) покрытия получают осаждением металлов при электролизе водных растворов соответствующих солей.
Гальванические покрытия получают под действием постоянного тока в кислых и цианистых электролитах.
Покрываемая деталь является отрицательным полюсом (катодом), а металлическое покрытие – положительным полюсом (анодом). Под действием ЭДС молекулы солей в водных растворах диссоциируют на электрически заряженные (положительно и отрицательно) частицы – ионы. При этом положительные ионы движутся к катоду и осаждаются на нем, т.е. на детали, а отрицательные – к аноду, где происходит их рекомбинация и переход металла электрода в виде положительных ионов в раствор. Перенос ионов под действием ЭДС называют электролизом.
Если металлическое покрытие имеет по сравнению с основным металлом более отрицательный потенциал, такое покрытие называют анодным. В этом случае металлическое покрытие образует с основным металлом гальваническую пару, в которой металлическое покрытие, являясь анодом, разрушается и предупреждает разрушение основного металла.
К анодным покрытиям относятся цинк, кадмий, олово.
Металлическое покрытие, которое имеет более положительный потенциал, чем основной металл, называют катодным. В этом случае металл детали и осажденное металлическое покрытие образуют гальваническую пару, анодом в которой является основной металл детали. При попадании влаги через дефекты в покрытии между покрытием и основным металлом основной металл разрушается.
К катодным покрытиям относятся никель, медь, серебро.
В радиоэлектронике применяют цинкование, кадмирование, никелирование, хромирование, серебрение и лужение. Изделия из стали чаще всего покрывают цинком, кадмием, никелем или хромом, а изделия из медных сплавов – никелем, серебром, оловом. Корпуса микросхем из ковара покрывают гальваническим никелем, который может служить защитным покрытием и подслоем для последующего нанесения золотого гальванического покрытия.
Металлизация – это процесс получения относительно толстого металлического покрытия.
Толстые металлические покрытия получают погружением детали в расплавленный металл (горячая металлизация) или с помощью пистолета-распылителя (горячее распыление).
Горячую металлизацию применяют для получения покрытий только на металлических деталях. Для металлизации используют цинк или олово. Покрытие оловом осуществляют при выполнении монтажных работ в производстве радиоэлектронной аппаратуры для получения поверхностного электропроводного слоя и защиты от коррозии.
Горячее распыление применяют для получения металлических покрытий на металле, керамике, пластмассе, стекле, конденсаторной бумаге, тончайшей ткани, полистирольной пленке и других материалах с низкой нагревостойкостью.
Нагретый в пистолете металл распыляют на поверхность детали нейтральным газом азотом или углекислым газом.
Вакуумные покрытия получают при нанесении тонкого слоя любого металла на поверхность металлических и неметаллических деталей в вакууме. При этом используют катодное распыление или вакуумное испарение.
Катодное распыление проводят в вакуумных установках. В качестве анода используют металлическую пластину, на которую закрепляют деталь. Катодом служит пластинка металла, которым эту деталь необходимо покрыть. Под действием разности потенциалов частицы с катода переносятся на анод и осаждаются на деталь. Процесс катодного распыления требует высокого напряжения (примерно 10...30 кВ) и протекает в течение нескольких часов.
Вакуумное испарение также проводят в вакуумных установках. Деталь закрепляют на держателе на определенном расстоянии от испарителя. Испаритель представляет собой вольфрамовую спираль, покрытую металлом, который подлежит испарению. Спираль нагревают в вакууме до температуры, при которой наступает интенсивное испарение и осаждение металла на деталь.
Вакуумное испарение находит более широкое применение, так как не имеет недостатков катодного распыления.
Химический способ применяют для получения металлических покрытий с помощью специальных растворов без электрического тока. Он основан на восстановлении ионов осаждаемого металла в результате взаимодействия с восстановителем. Восстановитель окисляется и отдает свои электроны. Находящиеся в растворе ионы металла присоединяют эти электроны, превращаются в атомы и осаждаются на деталь в виде металлической пленки. Реакция восстановления протекает лишь на металлической поверхности.
Наиболее широко применяют химическое никелирование и химическое меднение.
Химическое никелирование позволяет покрывать детали сложной формы и внутренние поверхности, которые не доступны для покрытия гальваническим способом. В микроэлектронике химический никель наносят на детали корпусов микросхем, которые герметизируются контактными методами сварки.
Химическое меднение используют для металлизации пластмасс при изготовлении печатных плат.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1402; Нарушение авторских прав?; Мы поможем в написании вашей работы!