
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Короткі теоретичні відомості. Методи очистки стічних вод від неорганічних забруднювачів
|
|
|
|
Методи очистки стічних вод від неорганічних забруднювачів
Екомоніторинг водойм
Лабораторна робота 2
2.1 Мета роботи. Вивчити теоретичні та прикладні основи методів екологічного моніторингу водного басейну та експериментально визначити вміст неорганічних забруднювачів у стічній воді до і після очистки фізико-хімічними методами, а також ступінь очистки води.
Внаслідок антропогенної діяльності відбувається забруднення гідросфери, класифікувати яке можливо наступним чином.
1 Хімічне – завдяки надходженню в водойми зі стічними водами ШР, як неорганічної так і органічної природи (всього зафіксовано 959 видів ШР).
Основними забруднювачами водойм є:
– СПАР – дуже токсичні речовини, утворюють з важкими металами комплекси з високою константою стійкості, які дуже важко зруйнувати при очистці води;
– пестициди – хімічні засоби захисту рослин (поділяють: за призначенням – гербіциди (боротьба з бур’янами), інсектициди (з шкідливими комахами), фунгіциди (з грибковими, плісенню); за хімічним складом: хлорорганічні (розчиняються в жировій тканині), фосфорорганічні (руйнують ЦНС), ртутьвмісні (руйнація клітин головного мозку); за токсичністю: сильнодіючі, високотоксичні, середньотоксичні, малотоксичні);
– нафта та нафтопродукти – 1 крапля дає плівку на поверхні води 1 м2 (1т–12км2), ця плівка не пропускає кисню, гине все живе;
– катіони – Pb2+ (порушення роботи ЦНС, хронічні захворювання мозку, канцероген. мутаген), Zn2+ (рак шлунку), Mо2+ (рак стравоходу), Mn2+ (анемія, ЦНС), Sr2+ (рахіт);
– аніони – Cl–, SO42–, NO3– (NO3– відновлюється в організмі до нітриту, який утворює комплексні сполуки з гемоглобіном крові, нездатні переносити кисень як і СО), крім того NO2– – канцероген, F– (карієс, руйнація зубів);
– гази – NH3, H2S (клітинна та ферментна отрута), наявність H2S, NH3 у воді свідчить про загнивання, таку воду не можна пити, Cl2 (захворювання сердцевосудинної системи та ЦНС, канцероген, зниження пам’яті. прогресуюча недоумкуватість).
2 Фізичне – пов’язане зі зміною фізичних властивостей води (температура, прозорість, вміст суспензій та інших нерозчинних компонентів, радіоактивних речовин. В р. Десна спостерігається перевищення вмісту радіонуклідів в 10-100 разів за норму.
3 Біологічне – виникає при надходженні до водойм різних видів рослин, тварин, мікроорганізмів, яких раніше тут не існувало. Перше місце по біологічному забрудненню займають комунально-побутові стоки.
Основними джерелами забруднення водойм є:
– стічні води промислових підприємств;
– стоки сільського господарства;
– стічні води судів морського та річного транспорту;
– поверхневий сток з урбанізованих територій;
– побутові стічні води.
Згідно з класифікацією, запропонованою Л. А. Кульським, забруднюючі речовини за їх фазово-дисперсним станом і відношенням до дисперсійного середовища поділяють на чотири групи. Домішки перших двох груп (крім високомолекулярних сполук) утворюють термодинамічно нестійкі гетерогенні системи, а двох інших – термодинамічне рівноважні оборотні гомогенні системи.
До першої групи належать нерозчинні у воді зависі (суспензії – глина у воді і т. і., емульсії – масла у воді), а також бактерії та планктон. Розмір їх часточок становить 10–3–10–7 м (>100 нм). Вони кінетично нестійкі і підтримуються у завислому стані динамічними силами водяного потоку. В стані спокою зависі осідають. Але бувають і стійкі суспензії. емульсії, що довго не руйнуються.
Друга група домішок поєднує гідрофільні й гідрофобні мінеральні та органо-мінеральні колоїдні часточки ґрунтів, недисоційовані і нерозчинні форми високомолекулярних гумусових речовин, детергенти та інші речовини. До цієї групи належать також віруси і мікроорганізми, які за своїми розмірами близькі до колоїдних часточок. Розміри дисперсних часток знаходяться в межах 10–7—10–9 м (1...100 нм). Кінетична стійкість гідрофобних домішок характеризується співвідношенням сил гравітаційного поля і броунівського руху. Агрегативна стійкість їх зумовлена електростатичним станом міжфазної поверхні і утворенням на поверхні частинок стабілізувальних шарів (гідратних оболонок, адсорбованих катіонів і аніонів). Сюди ж відносяться високомолекулярні сполуки.
Третя група забруднювальних домішок включає молекулярно-розчинні сполуки розміром менш ніж 10–9 м (<1 нм). До неї відносять розчинені гази, органічні речовини біологічного походження та інші домішки, що можуть міститися в складі промислових і господарсько-побутових стоків (частіше – низькомолекулярні сполуки органічної природи). У водному середовищі можливий перебіг двох процесів: сполучення різнорідних молекул з Н2О (гідратація) і сполучення однорідних молекул (асоціація). Молекулярно-розчинні речовини здатні за рахунок водневих зв'язків утворювати з водою неміцні сполуки, що існують лише в розчині. Велике значення ці зв'язки мають також при асоціації молекул розчиненої речовини. Необхідною умовою їх виникнення є достатня полярність валентних зв'язків у вихідних речовин.
До четвертої групи забруднювальних домішок належать електроліти – речовини з іонним або сильно полярним ковалентним зв'язком, які під впливом полярних молекул води дисоціюють на іони. Кристалічні структури цих речовин руйнуються переважно в результаті процесу гідратації.
Для кожної групи домішок можна виділити деякі специфічні фізико-хімічні методи контролю їх вмісту. При цьому враховують розмір часток, рухливість в електричному полі, взаємодію зі світловим випромінюванням, кінетичну нестійкість системи “вода – домішка” та інші особливості.
Основною нормуючою величиною для ШР в воді є їх ГДК, мг/л.
Гігієнічні ГДК (ГДКв) – базуються на підпорогових концентраціях ШР, при яких не спостерігається будь-яких функціональних змін в організмі людини. Ці ГДК встановлюються для водойм І та ІІ категорій (табл.2.1).
Рибогосподарські ГДК (ГДКрг) – це такі концентрації ШР, які при умові їх постійної наявності у воді не викликають загибелі риб та планктону, не зменшують товарних якостей риби та рибогосподарську цінність об’єкта. Ці ГДК встановлюються для водойм ІІІ та ІV категорій.
Таблиця 2.1 – Категорії водойм
| Категорія | Назва категорії | Призначення водойм |
| І | Гоподарсько-питна | Для водопостачання населення та харчової промисловості |
| ІІ | Культурно-побутова | Для купання, спорту та відпочинку населення |
| ІІІ | Рибогосподарська для цінних видів риб | Для збереження та відновлення цінних видів риб які мають підвищену чутливість до кисню |
| ІV | Рибогосподарська | Для інших видів риб |
Встановлюються чотири класи небезпеки ШР у воді:
1 – надзвичайно небезпечні: Tl, Be, Hg (ГДК 1·10–4...5·10–4 мг/л);
2 – високо небезпечні: Сd (0,001); Se, Те, Nb (0,01); Pb, Li (0,03); As, W, Ag (0,05); CH2O (0,05);
3 – небезпечні: Ti (0,1); Zn, Cu (1,0); ацетон (2,2);
4 – помірно небезпечні: гас (0.01; орг. зап.), нафта (0,1, орг. пл.), гліцерин (0,5, заг.).
ШР різняться за складом, в зв’язку з чим їх нормують (встановлюють ГДК) за принципом лімітуючого показника шкідливості (ЛПШ), під яким розуміють найбільш вірогідний несприятливий вплив кожної ШР на людину та довкілля (табл. 2.2).
Таблиця 2.2 – Види ЛПШ
| ЛПШ для водойм І та ІІ категорій | ЛПШ для водойм ІІІ та ІV категорій |
| Санітарно-токсикологічний – с.-т. | Санітарно-токсикологічний |
| Загальносанітарний – заг. | Загальносанітарний |
| Органолептичний – орг. (за запахом, кольором, присмаком, піною, плівкою – зап., кол., присм., пін., пл.), напр.: орг. пл. | Органолептичний |
| Токсикологічний | |
| Рибогосподарський |
Санітарні умови за вмістом забруднювачів відповідають нормі, якщо виконується умова:
SСі/ГДКі ≤ 1 (2.1)
де Сі – фактичні концентрації і-тої ШР у воді, мг/л, ГДКі – ГДК і-тої речовини, мг/л, n =3 (для водойм І та ІІ категорій), n =5 (для водойм ІІІ та ІV категорій).
Для кожного джерела забруднення встановлюється гранично допустимий скид (ГДС), г/с. ГДС — це маса забруднень у стічних водах, допустима для відведення з установленим режимом у певному пункті водного об'єкта за одиницю часу, з метою забезпечення норм якості води в контрольному пункті.
ГДС=Сm·q, г/с (2.2)
де Сm– максимально допустима концентрація ШР у стічній воді, г/л;
q – витрати стічної води, м3/с.
Розглянемо загальні вимоги до складу та властивостей води господарсько-питного призначення при скиданні у водойму стічних вод.
1. Водойма не повинна мати на поверхні води плівок будь-якого характеру.
2. Вміст завислих речовин не повинен перевищувати 1,5 мг/л.
3. Вода не повинна мати запахів і присмаків інтенсивністю понад два
бали. Інтенсивність запахів і присмаків за балами розподіляється так:
| Інтенсивність присмаку або запаху | Ніякого | Дуже слабкий | Слабкий | Помітний | Виразний | Дуже сильний |
| Бал |
Зазвичай виділяють такі види запахів: ароматний (квітковий, огірковий), землистий, болотний, гнильний, деревинний, цвільовий, хлорний, нафтовий, фенольний, сірководневий, непевний (не схожий на жоден із зазначених запахів). Смак розрізняють гіркий, кислий і солоний. Усі інші смакові відчуття кваліфікують як присмаки.
4. Вода не повинна мати забарвлення при розгляданні її в стовпчику заввишки 20 см. Кольоровість води за платино-кобальтовою або іміту-вальною шкалою не повинна перевищувати 20 град. В окремих випадках допускається до 35 град. (Один градус кольоровості відповідає вмісту в 1л розчину 2,49 мг хлорплатинату калію і 2,018 мг хлориду кобальту.)
5. Температура води в результаті скидання стічних вод не повинна під
вищуватися влітку більш як на 3°С, взимку — більш як на 5°С порівняно
з максимальною середньомісячною температурою в даному місяці за останні 10 років.
6. Реакція води має залишатися в межах рН = 6,5–8,5, тобто бути слаб-
окислою, нейтральною або слаболужною.
7. Мінеральний склад за сухим залишком (мінералізація) не повинен перевищувати 1000 мг/л (в окремих випадках допускається до 1500 мг/л), у тому числі хлоридів — 300, сульфатів — 500, нітратів (за азотом) — 10 мг/л (за NO3– – 45), загальна твердість — 7—10 ммоль • екв/л.
8. Вміст розчиненого кисню (при допустимому ступені забрудненості (індекс 0)) має становити не менш як 4 мг/л у будь-
який період року в пробі, відібраній до 12 год. дня (при помірній забрудненості (індекс 1) – 3 мг/л).
9. Біохімічна потреба кисню (БПКповн) при 20 °С не повинно перевищувати 3 мг О2/л, для І категорії водойм 1-6 мг О2/л, для ІІ (для індексу 1 відповідно 6 і 8). У чистих водоймах БПК не перевищує 2 мг О2/л, у
забруднених може досягати 50 мг О2/л. БПК – кількість кисню, що витрачається за певний проміжок часу на аеробне біохімічне окислення (розкладання) нестійких органічних сполук, які містяться в аналізованій воді. БПК визначають для різних проміжків часу: за 2 доби (БПК2), за 5 діб (БПК5), за 10 діб (БПК10), за 20 діб (БПК20).
10. Хімічна потреба кисню (ХПК), яка визначається дихроматним методом, показує кількість О2 необхідного для окислення всіх відновників, що містяться у воді, для водойм І і ІІ категорій становить ≤15 і ≤30 мг О2/л. По відношенню БПК/ХПК≥0,5 судять про можливість біодеградації ШР. ШР в яких БПК/ХПК<0,5 – заборонено до використання. Деякі галузі промисловості (нафтогазодобувна, перероблююча) вимагають, щоб це відношення було 0,8...0,9.
11. У воді не повинно бути збудників хвороб. Стічні води перед скиданням у водойму слід знезаражувати (хлорне вапно, Cl2, O3, Ag, УФ, УЗВ та ін.).
12. Отруйні речовини не повинні міститися в концентраціях, які перевищують ГДКв.
Крім нормативних вимог до якості води у водоймах, підприємства повинні незаперечне виконувати виробничі обмеження на скидання стічних вод. Забороняється скидати у водойми такі види стічних вод: 1) води, які за використання раціональної технології можуть бути максимально використані в системах оборотного водопостачання або організації безстічних виробництв; 2) води з цінними домішками, які необхідно утилізувати; 3) води, що містять виробничу сировину, реагенти, напівпродукти та кінцеві продукти виробництва в кількостях, які перевищують установлені нормативи технологічних витрат; 4) води, що містять шкідливі речовини, для яких не встановлені ГДК; 5) води, які з урахуванням їх складу та місцевих умов можуть бути використані для зрошування в сільському господарстві за умови дотримання санітарних вимог. Загальні вимоги до складу, властивостей стічних вод підприємств наведені в [10,12].
Не допускається скидання у водойми кубових залишків і технологічних відходів. Встановлені обмеження поширюються і на зливову каналізацію, що відводить атмосферну воду з промислових ділянок, товарно-сировинних баз та інших територій, стік з яких може спричинити забруднення водойм.
Контроль вимог до нормованих показників відбувається періодичним відбором проб з подальшим їх аналізом. Для контролю використовуються як автоматичні стації – АСКНС – В (здійснюється вимірювання 8-10 раніше згаданих параметрів), так і лабораторні методи.
Сучасний рівень розвитку промисловості і техніки потребує використання методів аналізу, які дозволяють визначати мікрокількості (до 10-7 %) різних речовин.
З цією метою широке використання отримали оптичні методи аналізу, засновані на взаємодії променевої енергії з речовиною, яка аналізується. За характером взаємодії променевої енергії і способу її зміни розрізняють:
1) абсорбційний аналіз, тобто аналіз на поглинання світла речовиною, яка визначається у видимій, ультрафіолетовій та інфрачервоній областях спектру (спектрофотометрія, фотоколориметрія);
2) аналіз на поглинання і розсіювання променевої енергії зваженими частинками речовини, яка визначається (турбідиметрія, нефелометрія);
3) флюорометричний (люмінесцентний) аналіз, заснований на вимірюванні вторинного випромінювання, яке виникає в результаті взаємодії променевої енергії з речовиною, яка визначається.
Найбільше розповсюдження набули абсорбційні методи аналізу і фотоколориметричні. Турбідиметричні і нефелометричні методи використовуються значно менше, в тих випадках, коли для речовини, яка визначається не вдається підібрати ефективні фотометричні реагенти. Флюорометричний (люмінесцентний) аналіз також має обмежене застосування тому, що тільки невелика частина сполук флуороцирує з достатньою інтенсивністю.
Фотометрія – один з основних методів визначення неорганічних забруднювачів стічної води.
Суть фотоколориметричного методу аналізу. В фотометричних методах аналізу вимірюють поглинання світла речовиною, яку аналізують після введення в розчин реактиву, який реагує з компонентом, що визначається в стічній воді, з утворенням сполук з інтенсивним забарвленням.
Будь-яка речовина відбиває і поглинає електромагнітне випромінювання. Речовини, які поглинають промені довжиною хвиль від 400 до 760 нм (видиме світло), забарвлені.
Характер і величина поглинання і відбивання світла залежить від природи речовини і його концентрації в суміші.
Фотоколориметрія – аналіз, заснований на вимірюванні поглинання видимого світла без попереднього виділення монохроматичного випромінювання (використовують біле світло, пропущене через світлофільтри). Світлофільтри пропускають промені тільки в конкретному проміжку довжин хвиль з шириною пропускання l1/2 max - l’ 1/2 max і практично повністю поглинають промені інших довжин хвиль (рис 2.1).
Колориметричний метод аналізу був використаний в кінці XVII ст. російським вченим В.М. Севергіним при аналізі мінеральної води. В основу аналізу покладено властивість забарвлених розчинів поглинати світло, яке проходить через речовину, з інтенсивністю Іо. Після проходження через речовину інтенсивність світла зменшується до І.
У відповідності до основного закону світлопоглинання – закон (Бугера–Ламберта–Бера, який покладений в основі більшості фотометричних методів аналізу), між поглинанням випромінювання розчином і концентрацією в ньому речовини, що поглинає (С) існує відношення:
І = І0*10-e×L×C (2.3)
де С – концентрація речовини, яка поглинає світло, моль/л.
L – товщина шару розчину, що поглинає світло, см.
 |
e – молярний коефіцієнт світлопоглинання.
Для визначення суті величини e приймають концентрацію розчину 1 моль/л і товщину шару 1 см. Тоді молярний коефіцієнт поглинання представляє оптичну густину 1 моль розчину, поміщеного в кювету, товщиною 1 см. Величина e показує індивідуальні властивості речовини, змінюючись із зміною довжини хвилі потоку і температури розчину.
Поглинання випромінювання можливо характеризувати величиною оптичної густини D:
D = - lgT (2.4)
D = lg 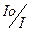 (2.5)
(2.5)
Величина D може приймати будь-які позитивні значення (від 0 до ¥), проте сучасні пристрої дозволяють вимірювати величини оптичної густини, не більше 2. Якщо врахувати рівняння (2.3), то можливо отримати рівняння:
D = e×L×C (2. 6)
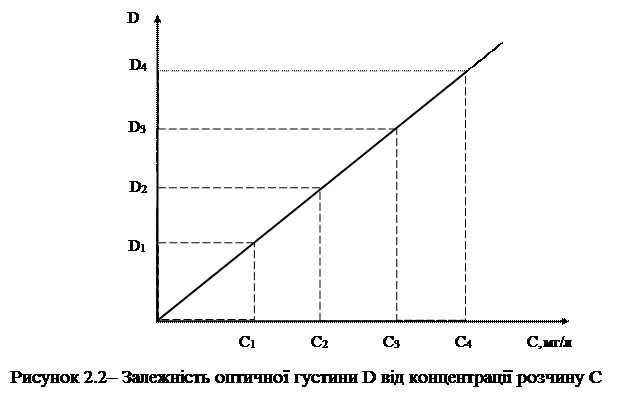
з якого виходить, що якщо світлофільтр для дослідженого розчину не суперечить закону Бугера–Ламберта–Бера, то оптична густина розчину прямо-пропорційна концентрації речовини в розчині. В цьому випадку графік залежності оптичної густини D від концентрації С є прямою лінією, яка починає рух від початку координат (рис. 2.2).
Будь-яке фотометричне визначення виконуються в три етапи:
1. Одержання забарвленого стану дослідженої сполуки за допомогою певної хімічної реакції.
2. Вимірювання світлопоглинання продукту реакції, наприклад, вимірювання оптичної густини.
3. Визначення кількості речовини, що аналізується за величиною оптичної густини.
Порядок виконання фотоколориметричного аналізу представлений схемою, яка зображена на рис. 2.3.

Методи визначення концентрації розчину.
Існує декілька методів визначення концентрації речовини на основі вимірювання оптичної густини D.
Метод розрахунку.
Оснований на використанні основного закону світлопоглинання.
При відомій товщині шару розчину L і коефіцієнта e, концентрація розчину, що аналізується Сx розраховується після вимірювання оптичної густини за формулою:
Сx = D/(e·L) (2.7)
Обмеження метода в тому, що не завжди відома величина молярного коефіцієнта поглинання e.
Метод стандарту.
Оснований на вимірюванні оптичної густини розчину, що аналізується і стандартного розчину:
Dx = e×L×Cx (2.8)
Dст = e×L×Cст (2.7)
Невідому концентрацію розчину розраховують за формулою:
Cx =  (2.9)
(2.9)
при постійних e, L. Метод використовують при одиничному аналізі. Для зменшення похибки концентрації стандартного розчину підбирають так, щоб оптичні густини Dx і Dст відрізнялися як можливо менше.
Метод градуйованого графіка.
Оснований на зміні оптичної густини деякої кількості стандартних розчинів відомих концентрацій С1, С2, С2 … Сn і побудови залежності D = f (C). 
При виконанні основного закону світлопоглинання, ця залежність виражається графічною прямою, яка виходить з початку координат.
Концентрацію розчину знаходять за графіком (рис. 2.2), після виміру його оптичної густини Dx.
4. Метод добавок.
Оснований на порівнянні оптичних густин розчину невідомої концентрації і того ж розчину з добавками стандартного розчину відомої концентрації. Метод добавок являється різновидом метода порівняння. Застосовувати цей метод можливо тільки в тому випадку, коли концентрації розчинів не суперечать основному закону світлопоглинання.
5. Диференційний метод являється різновидом методу градуйованого графіка і застосовується для визначення високих концентрацій ШР.
6. Метод фотометричного титрування оснований на визначенні точки еквівалентності за зміною оптичної густини в процесі титрування.
Фотометричні методи забезпечують високу точність (помилка 1-2 %) і широко використовуються у визначенні концентрації розчинів.
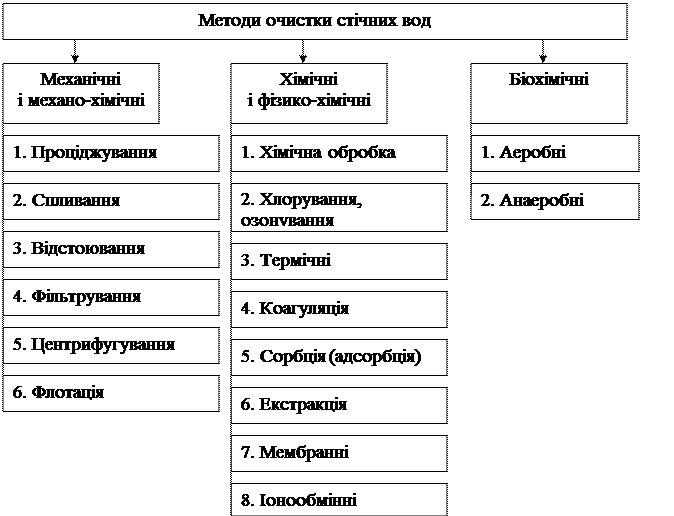
Для виконання всіх зазначених вище вимог стічні води перед скиданням у водойми слід очистити. Всі методи очистки поділяють на три основні групи – механічні і механо-хімічні, хімічні і фізико-хімічні та біохімічні (див. рис. 2.4).
Систематизація забруднювальних домішок на основі їх дисперсного стану та фізико-хімічних властивостей дає змогу згрупувати всі способи очистки також у чотири групи, як і власне домішки. Вихідні положення цього принципу можна сформулювати так: 1) фазово-дисперсний стан домішок води зумовлює їх поведінку в процесі очистки; 2) кожному фазово-дисперсному стану забруднювальних домішок відповідає сукупність методів, що дає змогу досягти необхідних якісних показників очищеної води шляхом зміни цього стану або без зміни його.
В основу технології очистки води від домішок кожної групи закладені процеси, що відбуваються під дією сил, які найефективніше впливають на дану дисперсну систему. Так, для видалення гетерофазних домішок першої групи застосовуються такі процеси: механічне розділення в гравітаційному полі або під дією відцентрових сил, а також фільтрування крізь пористі матеріали й дрібну сітку; адгезія на високодисперсних і зернистих матеріалах, а також гідроксидах алюмінію або заліза і глинистих мінералах; агрегація флокулянтами; флотація домішок тощо; для патогенних організмів – бактерицидна дія. При цьому комплекс очисних споруд включає відстоювання, фільтрування, мікропроціджування, центрифугування та безреагентну флотацію.
 |
Проціджування використовують для попереднього очистки води з метою вилучення механічних домішок значного розміру.
Спливанням очищають стічні води від нафтопродуктів у нафтовловлювачах, від жиру — в жироуловлювачах. З цією метою можна також використовувати флотатори і пристрої для диспергування повітря, флотацію із застосуванням реагентів.
Відстоювання використовують для вилучення зі стічних вод завислих грубодисперсних домішок, наприклад глинистих часточок, концентрацією до 500 мг/л, які можуть мати кольоровість 50 град. Для цього використовують відстійники різних конструкцій: вертикальні, горизонтальні та радіальні. Великі горизонтальні відстійники будують із залізобетону завдовжки до 36 м, шириною від 6 до 18 м і глибиною до 5 м. Радіальні відстійники (рис. 2.5) мають діаметр від 18 до 60 м і глибину до 6 м. Тривалість відстоювання становить близько 1,5 год. Горизонтальні відстійники застосовують у разі витрати стічних вод, до 20 тис. м3 на добу, радіальні – понад 20 тис. м3.
 |
Для видалення завислих забруднювальних речовин концентрацією до 50 мг/л, які мають кольоровість до 50 град, використовують попередні фільтри. Попередні фільтри застосовують для видалення завислих домішок концентрацією до 1000 мг/л і кольоровістю до 50 град. Планктон за вмістом понад 1000 кл/см3 і зависі видаляють за допомогою мікрофільтрів. Для видалення грубодисперсних домішок застосовують безперервно діючі центрифуги та гідроциклони.
Фільтруванням називають процес розділення неоднорідних систем (суспензій) за допомогою пористих перегородок і шарів, які затримують одну (тверду) фазу цих систем і пропускають іншу (рідку). Апарат, у якому здійснюють цей процес, називають фільтром. По різні боки перегородки створюють різницю тиску, під дією якої здійснюється транспортування рідини крізь перегородку і затримання осаду на ній. Цей процес розділення суспензій називають фільтруванням із затриманням осаду. В тому разі, якщо тверді часточки проникають у пори фільтрувальної перегородки, затримуючись у них і утворюючи осад, називають фільтруванням із закупорюванням пор.
 |
Під час фільтрування стічних вод, що містять завислі речовини, крізь шар допоміжних матеріалів (пісок, діатоміт, деревне борошно та ін.) завислі речовини можуть відкладатися на поверхні фільтрувального шару (плівкове фільтрування) або в порах фільтрувального шару, а також можливе одночасне утворення плівки та відкладання завислих речовин у порах фільтрувального шару (рис. 2.6). Залежно від швидкості фільтрування зернисті фільтри поділяють на повільні (0,1—0,2 м3/год), швидкі (5,5—15 м3/год) і надшвидкі (понад 25 м3/год). За розміром зерен розрізняють фільтри дрібнозернисті (повільні фільтри з розміром зерен верхнього шару піску 0,5— 0,8 мм) і крупнозернисті (попередні фільтри з розміром верхнього шару піску 1—2 мм). Фільтри, завантажені однорідним шаром фільтрувального матеріалу, називають одношаровими. Фільтри, завантажені неоднорідним, за щільністю й розміром зерен, фільтрувальним матеріалом, називають багатошаровими.
Центрифугуванням очищають стічну воду від домішок з застосуванням відцентрових сил.
Флотація ґрунтується на різній змочуваності мінералів (домішок) водою. Суть процесу полягає в специфічній взаємодії завислих речовин з бульбашками тонкодиспергованого у воді повітря з наступним утворенням на поверхні води шару піни з вилученими домішками. Оптимальні розміри домішок становлять 10–5—10–3 м. Тонкодисперсні часточки розміром менш як 5—10 мкм флотуються дуже важко, тому їх необхідно попередньо укрупняти, наприклад, за допомогою коагуляції або флокуляції. Флотаційне очищення стічних вод здійснюють в апаратах двох типів, які відрізняються способом диспергування повітря: турбіною насосного типу (рис. 2.7) і напірною флотацією з додаванням коагулянту. В установках першого типу повітря розпилюється біля дна. Бульбашки спливають і виносять із собою домішки забруднень. Піну із забрудненнями знімають з поверхні. В установках напірного типу аерація води здійснюється під тиском. Флотацією очищають стічні води від твердих завислих речовин, нафтопродуктів, масел та інших емульгованих речовин, а також від окремих іонів розчинених речовин.
 |
Адсорбцію на високодисперсних і зернистих матеріалах, а також на гідроксидах алюмінію й заліза застосовують під час фільтрування крізь намивний шар допоміжної речовини для видалення зі стічних вод тонко-дисперсних завислих сполук заліза і магнію (за потреби глибокого їх видалення). Для цього використовують діатомітові та інші намивні фільтри. Завислі речовини з вмістом до 150 мг/л і кольоровістю до 150 град видаляють фільтруванням з використанням явища контактної коагуляції та застосуванням установок для приготування й дозування розчинів реагентів, контактних освітлювачів або контактних фільтрів. Патогенні бактерії та спори видаляють обробкою високодисперсними глинистими мінералами з наступним відстоюванням та фільтруванням. Для здійснення цих процесів застосовують установки для приготування і дозування суспензії глинистих мінералів, змішувачі, відстійники та фільтри. Під час обробки води коагулянтами з наступним видаленням зависей відстоюванням і фільтруванням очищають стічні води з необмеженою кількістю й кольоровістю завислих речовин, а також від патогенних бактерій і спор. Для цього використовують установки для приготування й дозування розчинів реагентів, змішувачі, камери утворення пластівців, освітлювачі або відстійники та фільтри.
Видалення домішок другої групи (колоїдно-розчинні, високомолеку-лярні речовини тощо) здійснюють із застосуванням діалізу, ультрафільтрації, окислення хлором і озоном, коагуляції колоїдних домішок, адсорбції на гідроксидах алюмінію або заліза, на високодисперсних глинистих матеріалах, а також електрофорезу та електродіалізу. Для видалення завислих колоїдно-дисперсних речовин застосовують ультрафільтрацію крізь крупнопористі мембрани. При видаленні колоїдних і високомолекулярних сполук, що зумовлюють окислюваність і кольоровість води (35— 200 град), а також забруднення її вірусами, здійснюють окиснення хлором, озоном та іншими сполуками із застосуванням хлораторних і озонаторних установок.
Коагуляцію застосовують для видалення зі стічних вод найдрібніших колоїднодисперсних глинистих часточок, білкових речовин та інших ви-сокомолекулярних сполук. Коагуляцію здійснюють шляхом введення в очищувану воду незначної кількості електролітів — Аl2(SО4)3, FеSO4 та деяких інших сполук, які називають коагулянтами. Фізико-хімічна суть цього процесу в спрощеному вигляді полягає в тому, що коагулянт, гід-ролізуючись, утворює позитивно заряджені аквагідроксокомплекси алюмінію та заліза, які адсорбуються на поверхні негативно заряджених колоїдних домішок і нейтралізують їхній заряд. Чим більший заряд аквагідроксо-комплексів, утворених під час гідролізу коагулянтів, тим менші їх витрати на коагуляцію. В результаті збільшення розмірів часточок під час адсорбції вони осідають у відстійниках під дією сили гравітації. Одночасно йде процес адсорбції на поверхні осаду домішок органічних забарвлених речовин, внаслідок чого вода знебарвлюється.
Адсорбцію застосовують переважно для видалення з води органічних сполук (докладніше дивись лабораторну роботу 3).
Хімічні методи очищення ґрунтуються на проведенні різноманітних хімічних реакцій, які нейтралізують токсичні речовини, руйнують їх, переводять у газоподібний стан або осад. Наприклад, кислі стічні води металургійних та інших заводів нейтралізують, обробляючи вапном або фільтруючи через вапняк (СаСО3), магнезит (MgCO3), доломит (MgCO3×СаСО3) – так звана “суха” нейтралізація. За допомогою хімічних методів здійснюють пом'якшення води з видаленням солей твердості содово-вапняковим та фосфатним методами, видалення кольорових і важких металів, силіцію, заліза, магнію та ін. Щоб хімічні методи були рентабельні, треба додержувати двох головних умов: 1) зменшувати об'єми очищуваної води, збільшуючи за рахунок цього концентрації забруднюючих речовин; 2) утилізувати виділені сполуки.
Виділення з води молекулярно-розчинних домішок і газів, що належать за фазово-дисперсним станом до третьої групи, здійснюють десорбцією газів і відгонкою летких органічних сполук (феноли та ін.) у процесі аерації з використанням розбризкувальних басейнів, аераторів і дегазаторів різних типів. Для цього використовують також евапорацію паро-циркуляційним методом або азеотропну відгонку. Доочищення від H2S (0,3—0,5 мг/л), а також від летких органічних сполук після аерації, здійснюють окисненням із застосуванням хлору, озону, перманганату калію та інших окисників. За допомогою окиснення озоном можна очистити стічну воду від тетраетилсвинцю за наявності каталізатора – силікагелю.
До четвертої групи забруднювальних домішок відносяться електроліти (кислоти, луги, солі), що є гомогенними системами. Для їх видалення з води застосовують зворотний осмос, трансформацію іонів у малорозчинні та малодисоційовані сполуки, сепарацію іонів при різних фазових станах води, фіксацію іонів на твердій фазі іонітів (іонний обмін), електродіаліз та вилучення іонів металів їх поглинанням та накопиченням мікробами.
 |
Процес очистки води, що полягає у застосування явища “осмос” – це проникнення молекул розчинника в розчин неелектроліту (електроліту) під дією осматичного тиску (p). Осмотичний тиск розчинів навіть у разі невисокої мінералізації досить значний. Так, для морської води з вмістом солі 3,5 % він становить 2,5 МПа (рис. 2.8 а,б). Якщо прикласти (рис. 2.8 в) гідростатичний тиск р, який більше p, то відбувається зворотній осмос: розчинник просочується із забрудненого електроліта через мембрану в судину чистої води. Робочий тиск в установках для опріснення визначається вмістом солей у розчинах і для морської води його підтримують у межах 4-5 МПа. Зворотній осмос застосовують для стічних вод з вмістом солей 20-35 г/л.
Іонообмінний метод очистки стічних вод ґрунтується на використанні іонообмінних смол. Він перспективний, але поки що відносно дорогий і застосовується в тих випадках, коли потрібне тонка очистка води. Іонообмінний метод забезпечує практично повне очищення води, яке не потребує ніякого додаткового. Цей метод використовується для добування із стічних вод золота, срібла, платини, міді, хрому, молібдену, ванадію, нікелю, кобальту, заліза, фенолу, радіоактивних та деяких інших речовин. Процес проводять в іонітових фільтрах (докладно дивись лабораторну роботу 5).
Електроліз звичайно використовують для вилучення із стічних вод цінних металів: міді, хрому тощо. Застовувати цей метод для добування вільних металів доцільно тільки при досить високій концентрації іонів. Електролітичний метод використовується також для очищення, стічних вод від ціаністих сполук, які на аноді окиснюються, а потім гідролізуються до карбонатів – аніонів (СО3–) і катіону амонію (NH4+). Ефективно очищуються хромвмісні стічні води за допомогою електролізу з залізними електродами. При цьому можливі два варіанти. У лужному середовищі іони заліза (ІІ), що виділяються з розчинного аноду, відновлюють хромати у хроміти (тетрагідроксохромати – ІІІ) й утворюють нерозчинний осад хроміту заліза: Fe(CrO2)2 (чи Fe[Cr(OH)4]2), який вилучається механічним способом. У кислому середовищі залізо (ІІ) відновлює шестивалентний хром до тривалентного, який при нейтралізації розчину лугом вилучається у вигляді осаду гідроксиду хрому (ІІІ) (докладно дивись лабораторну роботу 4).
Термічний метод очищення полягає в спалюванні токсичних органічних речовин, що містяться в стічних водах, у присутності кисню повітря (докладно дивись лабораторну роботу 3).
Останнім часом для очищення стічних вод використовується також озонування. Озон - сильний окисник, і його легко добути на місці в озонаторах з кисню повітря. Перспективним в, наприклад, процес очищення стічних вод від тетраетилсвинцю окисненням його озоном до металічного свинцю на поверхні каталізатора - силікагелю. Озонування застосовується також для очищення та знезаражування питної води замість хлорування. Вода при цьому виходить прозора, без смаку й запаху, властивих воді водойм.
Магнітна обробка та радіоопромінення використовується для зміни фізичних властивостей води (накип не осаджується на поверхні апарату, а утворюється в об’ємі води, а потім осаджується).
Екстракція застосовується для вилучення із стічних вод фенолів, жирних кислот та інших речовин за допомогою обробки їх різними органічними розчинниками, які не змішуються з водою, наприклад бензолом, бутилацетатом та ін. Речовини, що містяться в стічних водах, переходять в екстрагент, який відокремлюється відстоюванням. Потім екстрагент відганяється і повертається у виробництво (дивись лабораторну роботу 3).
Аерація проводиться в основному з метою збільшення вмісту кисню у воді перед біохімічними методами очистки.
Дистиляція проводиться з метою отримання знесоленої води.
Біохімічні методи очищення стічних вод застосовуються для повного вилучення з них органічних речовин. Біохімічні методи очищення застосовуються на підприємствах харчової промисловості, заводах, що виробляють синтетичний каучук, віскозний шовк і після міських очисних споруд.
Методи біохімічного очищення грунтуються на використанні діяльності різних мікроорганізмів. Серед них розрізняють аеробний процес, який здійснюється в присутності кисню, й анаеробний - без доступу кисню (докладно дивись лабораторну роботу 3).
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1212; Нарушение авторских прав?; Мы поможем в написании вашей работы!