
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Аналитическое выражение работы газов
|
|
|
|
Все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил
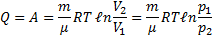
чтобы при работе расширения температура не изменялась, к газу в течение изобарного процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.
6. Первый закон термодинамики.
Внутренняя энергия может изменяться только под влиянием внешних воздействий, то есть в результате сообщения системе количества теплоты Q и совершения над ней работы (- А):
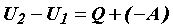
или
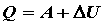 . (11)
. (11)
Это выражение представляет собой закон сохранения энергии в применении к макроскопическим системам и является математической формулировкой I-го начала термодинамики:
количество тепла, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
Если в изолированной системе (Q = A = 0) не происходит никаких превращений энергии, кроме теплообмена между телами, входящими в эту систему, то количество теплоты, отданное охлаждающимися при этом телами, равно количеству теплоты, полученному телами, которые нагреваются. Суммарная внутренняя энергия системы при этом не меняется.
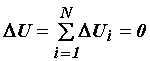 . (12)
. (12)
Уравнение (12) называется уравнением теплового баланса.
Применим первое начало термодинамики для получения выражений для теплоемкости идеального газа.
Теплоемкость системы численно равна количеству теплоты, которое необходимо сообщить системе, чтобы ее температура увеличилась на 1 Кельвин.
Если система получила количество тепла DQ, и ее температура изменилась на DT, то теплоемкость этой системы будет равна:
C = DQ/DT. (13)
Если под системой понимается 1 моль вещества, то теплоемкость называется молярной и обозначаетсяС, если под системой понимается единица массы вещества, то теплоемкость называется удельной и обозначается cуд:
cуд = C/M. (14)
Элементарное количество теплоты DQ, сообщаемое системе, представляющей собой 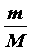 молей идеального газа, для изменения ее температуры от Т до Т + DT, равно:
молей идеального газа, для изменения ее температуры от Т до Т + DT, равно:
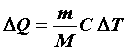 . (15)
. (15)
Внутреннюю энергию можно изменить двумя способами: путем передачи теплоты и путем совершения работы. При теплопередаче молекулы более нагретого тела передают часть своей энергии хаотического движения молекулам более холодного тела. Переданное количество теплоты является мерой изменения внутренней энергии каждого из тел: DU = Q.
Принято считать, что Q > 0, если тело получает энергию, и Q < 0, если тело отдает свою энергию. При совершении механической работы должно происходить направленное перемещение тел под действием сил, например, перемещение поршня в цилиндре с газом. Если газ расширяется, то сила давления газа на поршень совершает положительную работу (A > 0) за счет внутренней энергии газа. Если внешние силы больше силы давления газа, то газ сжимается и работа газа будет отрицательной (A < 0), при этом внутренняя энергия увеличивается.
В обоих случаях будет справедливо уравнение DU = – A. Если система одновременно совершает работу и получает или отдает теплоту, то изменение ее внутренней энергии DU = Q – A.
Уравнение DU = Q – A называется первым законом термодинамики (или первым законом термодинамики).
Изменение внутренней энергии термодинамической системы DUравно разности полученного количества теплоты Q и работы A, совершенной системой.
Первый закон термодинамики является законом сохранения энергии для тепловых процессов. Согласно ему A = Q – DU. Этот закон говорит о том, что любая машина (любой двигатель) может совершать работу только за счет получения извне некоторого количества теплоты или уменьшения своей внутренней энергии. Многие изобретатели пытались построить машины, которые совершали бы работу, не тратя никакой энергии. Эти машины назывались вечными двигателями первого рода.
Вечный двигатель первого рода не возможен – таков вывод из первого закона термодинамики.
7. Функции состояния газов. Внутренняя энергия газов.
Внутренняя энергия термодинамическая функция состояния системы, ее энергия, определяемая внутренним состоянием. Внутренняя энергия складывается в основном из кинетической энергии движения частиц (атомов, молекул, ионов, электронов) и энергии взаимодействия между ними (внутри- и межмолекулярной). На внутреннюю энергию влияет изменение внутреннего состояния системы под действием внешнего поля; во внутреннюю энергиювходит, в частности, энергия, связанная с поляризацией диэлектрика во внешнем электрическом поле и намагничиванием парамагнетика во внешнем магнитном поле. Кинетическая энергия системы как целого и потенциальная энергия, обусловленная пространственным расположением системы, во внутреннюю энергию не включаются. Втермодинамике определяется лишь изменение внутренней энергии в различных процессах. Поэтому внутреннюю энергию задают с точностью до некоторого постоянного слагаемого, зависящего от энергии, принятой за нуль отсчета.
Внутренняя энергия U как функция состояния вводится первым началом термодинамики, согласно которому разность между теплотой Q, переданной системе, и работой W, совершаемой системой, зависит только от начального и конечного состояний системы и не зависит от пути перехода, т.е. представляет изменение фуникции состояния ΔU
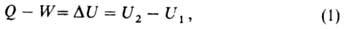
где U1 и U2 - внутренняя энергия системы в начальном и конечном состояниях соответственно. Уравнение (1) выражаетзакон сохранения энергии в применении к термодинамическим процессам, т.е. процессам, в которых происходит передача теплоты. Для циклического процесса, возвращающего систему в начальное состояние, ΔU=0. В изохорных процессах, т.е. процессах при постоянном объеме, система не совершает работы за счет расширения, W=0 и теплота, переданная системе, равна приращению внутренней энергии: Qv=ΔU. Для адиабатических процессов, когда Q=0, ΔU=-W.
Внутренняя энергия системы как функция ее энтропии S, объема V и числа молей mi i-того компонента представляет собой термодинамический потенциал. Это является следствием первого и второго начал термодинамики и выражается соотношением:
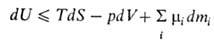
где Т - абсолютная температура, р - давление, μi - химический потенциал i-того компонента. Знак равенства относится к равновесным процессам, знак неравенства - к неравновесным. Для системы с заданными значениями S, V, mi (закрытая система в жесткой адиабатной оболочке) внутренняя энергия при равновесии минимальна. Убыль внутренней энергии в обратимых процессах при постоянных V и S равна максимальной полезной работе (см. Максимальная работа реакции).
Зависимость внутренней энергии равновесной системы от температуры и объема U=f(T, V) называется калорическимуравнением состояния. Производная внутренней энергии по температуре при постоянном объеме равна изохорнойтеплоемкости.
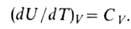
Внутренняя энергия идеального газа от объема не зависит и определяется только температурой.
Экспериментально определяют значение внутренней энергии вещества, отсчитываемое от ее значения при абсолютном нуле температуры. Определение внутренней энергии требует данных о теплоемкости СV(Т), теплотах фазовых переходов, об уравнении состояния. Изменение внутренней энергии при химических реакциях (в частности, стандартная внутренняя энергия образования вещества) определяется по данным о тепловых эффектах реакций, а также по спектральным данным. Теоретический расчет внутренней энергии осуществляется методами статистической термодинамики, которая определяет внутреннюю энергию как среднюю энергию системы в заданных условиях изоляции (например, при заданных Т, V, mi). Внутренняя энергия одноатомного идеального газа складывается из средней энергии поступательного движения молекул и средней энергии возбужденных электронных состояний; для двух- и многоатомных газов к этому значению добавляется также средняя энергия вращения молекул и их колебаний около положения равновесия. Внутренняя энергия 1 моля одноатомного идеального газа при температурах порядка сотен К составляет3RT/2, где R - газовая постоянная; она сводится к средней энергии поступательного движения молекул. Для двухатомного газа мольное значение внутренней энергии - около 5RT/2 (сумма поступательного и вращательного вкладов). Указанные значения отвечают закону равнораспределения энергии для названных видов движения и вытекают из законов классической статистической механики. Расчет колебательного и электронного вкладов во внутреннюю энергию, а также вращательного вклада при низких температурах требует учета квантовомеханических закономерностей.Внутренняя энергия реальных систем включает помимо вкладов, учитываемых для идеального газа, также среднюю энергию межмолекулярных взаимодействий.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1495; Нарушение авторских прав?; Мы поможем в написании вашей работы!