
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтальпия жидкости и газа. Уравнение энтальпии
|
|
|
|
Энтальпия -
это "термодинамический потенциал " используемый в химической термодинамике реакций и не циклических процессов.
однозначная функция состояния термодинамической системы при независимых параметрах энтропии и давления, связана с внутренней энергией соотношением, приведенным ниже.
это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту.
Энтальпия определяется как:
H = U + PV
где
H = энтальпия
U = внутренняя энергия
P = давление
V = объем системы
При постоянном давлении изменение энтальпии равно количеству теплоты, подведенной к системе, поэтому энтальпию часто называют тепловой функцией или теплосодержанием. В состоянии термодинамического равновесия энтальпия системы минимальна.
Энтальпия является точно измеряемым параметром, когда определены способы выражения трех других поддающихся точному определению параметров формулы выше.
9. Энтропия газа и Т-S диаграмма.
Теплота q не является функцией состояния, количество теплоты выделившейся или поглотившейся в процессе зависит от самого процесса. Функцией состояния является энтропия обозначается S размерность [Дж/К]
dS = dQ/T
где dS – дифференциал энтропии; dQ – дифференциал теплоты; Т – абсолютная температура;
Удельная энтропия - отношение энтропии тела к его массе. Удельная энтропия s является справочной величиной. Удельная энтропия - функция состояния вещества, принимающая для каждого его состояния определенное значение:
s = f (Р, v, Т) [Дж/(кг x K)]
Тепловая Т- S диаграмма.
Удельную энтропию можно применять совместно с одним из основных параметров для графического изображения процессов. Аналогично тому как мы строили изменение объема в зависимости от изменения температуры мы можем изобразить некоторый процесс изменения энтропии и температуры в Т- S координатах. В этом случае любая точка на графической плоскости соответствует определенному состоянию рабочего тела, а линия от точки 1 до точки 2 отображает некий термодинамический процесс. Особенностью Т- S координат является то, что площадь под линией процесса соответствует количеству энергии отданной или полученной рабочим телом.
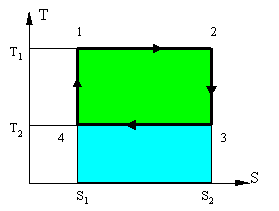
| Рисунок. Т – S диаграмма цикла Карно. |
На данной диаграмме (рисунок 5) представлен некий замкнутый цикл. Система последовательно переходит из точки 1 в 2 затем 3, 4 и снова в 1. Из графика видно, что процесс 1 => 2 является изотермическим (происходит при Т1 = const) и процесс 3 => 4, также является изотермическим (происходит при T2=const). Процессы 2 => 3 и 4 => 1 являются адиабатными, поскольку в них не происходит изменение энтропии то dS = 0, следовательно dQ = 0 или Q = const. Причем в процессе 2 => 3 происходит охлаждение рабочего тела за счет совершения работы телом, а в процессе 4 => 2 происходит нагрев рабочего тела, за счет совершения работы над телом.
Количество тепла подводимое к системе: Q1 = T1 × (S2-S1) - площадь прямоугольника 1-2-S2-S1-1 (вся область закрашенная голубым и зеленым).
Количество тепла отдаваемое системой: Q2 = T2 × (S2-S1) площадь прямоугольника 3-S2-S1-4-3 (область закрашенная голубым цветом).
Работа цикла - разность подведенной и отведенной теплоты: L = Q1 - Q2 (область закрашенная зеленым).
К.П.Д цикла:
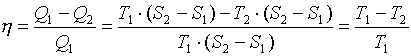
Главной особенностью данного цикла является то, что при данном перепаде температур у любого другого цикла КПД будет меньше. Другими словами максимально возможным КПД при данном перепаде температур является КПД цикла Карно. Диаграмма Т-S дает наглядное доказательство этого утверждения. Любой другой цикл в диапазоне температур Т1-Т2, на диаграмме будет иметь соотношение площадей меньшее чем соотношение площадей прямоугольников. В связи с площадями на диаграмме возникло выражение - степень заполнения цикла – насколько площади работы цикла близки к площадям прямоугольников
Важным следствием из формулы для КПД цикла Карно является то, что для увеличения КПД необходимо увеличивать температуру подвода тепла T1, и снижать температуру отвода тепла T2. На любых энергетических установках с паро - водяным циклом, использующих в качестве конечного поглотителя, тепла окружающие пространство, (АЭС, ТЭЦ) зимой к.п.д. выше за счет снижения температуры окружающей среды T2.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 2900; Нарушение авторских прав?; Мы поможем в написании вашей работы!