
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молярная концентрация
|
|
|
|
Задачи для самостоятельного решения
1. Вычислить массовую долю соли в растворе. Масса раствора 320 г. Масса щелочи 16 г.
2. 45 г соли растворили в 135 г воды. Вычислить массовую долю соли в растворе.
3. Вычислить массу вещества аммиака, если известно, что объем раствора составляет 1,5 л, плотность раствора 1,056 г/мл, а массовая доля аммиака равна 10 %.
4. Вычислить массу спирта в растворе ацетона в спирте, если
известно, что объем раствора составляет 400 мл, плотность раствора составляет 1, 14 г/мл, а массовая доля ацетона равна 20 %.
5. К раствору массой 510 г с содержанием вещества 35% добавили 100 мл воды. Какова массовая доля полученного раствора?
6. Из раствора массой 112 г с содержанием вещества 40% вещества выпарили 25 мл воды. Какова массовая доля полученного раствора?
7. Определить массу углекислого газа, если в реакцию с соляной кислотой вступило 200 мл 10 %-го раствора карбоната натрия; ρ (р-ра Na2CO3) = 1, 19 г/мл.
8. Смешали 300 мл раствора (ρ = 1,23 г/мл) с массовой долей вещества 10% и 0,065 л раствора с массовой долей того же вещества 12 %. Определить массовую долю вещества (в %) в полученном растворе.
Важная величина при расчете всех концентраций – количество вещества (моль)
Количество вещества: ν = 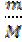 [ г/моль]
[ г/моль]
Количество вещества обозначается ν (ню), выражается в моль
Молярная масса (М): г/моль; кг/ моль; кг/ кмоль. Чаще пользуются размерностью г/моль
m
M =- ----------; m = M.ν
ν
Задача 10: Вычислить массу серной кислоты количеством вещества 3 моль.
 Дано: Решение:
Дано: Решение:
m = M. v = 98 г / моль. 3 моль = 294 г
v = 3 моль
М (H2SO4) = 98 %
m (H2SO4) -? Ответ: масса трех моль кислоты составляет
294 г.
Молярная концентрация растворов (С):

С - молярная концентрация – это число молей вещества (количество вещества), содержащихся (содержащегося) в 1 л или 1 дм3 раствора.
 |  | ||||
 | |||||
ν m

 С = C = à m = C· M · V
С = C = à m = C· M · V
V M ·V
Математически: это частное от деления количества вещества, содержащегося в системе к объему системы.
Например, С = 0,1 моль/дм3 (моль/л)
Обычно, расчет молярной концентрации проводят до третьего знака после запятой (третья значащая цифра после запятой) с округлением:
получилось 1,3462 - оставляем 1,346 моль/л
получилось 0, 2537 – оставляем 0, 254моль/л
или до четвертого знака после нулей после запятой:
получилось 0, 01276 – оставить 0,0128 моль/л
Задача 11: В растворе объемом 2 л содержится 12 моль аммиака. Вычислить молярную концентрацию раствора аммиака.
Дано: Решение:
V р-ра = 2 л ν 12 моль

 ν = 12 моль Саммиака = = = 6 моль /л
ν = 12 моль Саммиака = = = 6 моль /л
 V 2 л
V 2 л
Саммиака -? Ответ: молярная концентрация равна
6 моль /л
Задача 12: Определить массу бромида бария, необходимого для приготовления 200 мл раствора с молярной концентрацией эквивалента 0,05 моль\л. М (ВaBr2) = 137 г/моль.
 |
Дано: Решение:
V р-ра = 200 мл m = C· M · V
С(ВaBr2) = 0,05 моль /л m = 0,05 моль/л· 137г/моль · 0,2 л =
 = 1,37 г
= 1,37 г
m(ВaBr2) -? Ответ: m(ВaBr2) = 1,37 г
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 916; Нарушение авторских прав?; Мы поможем в написании вашей работы!