
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Разбавление раствора
|
|
|
|
Смешали m1 граммов раствора №1 c массовой долей вещества w1 и m2 граммов раствора №2 c массовой долей вещества w2. Образовался раствор (№3) с массовой долей растворенного вещества w3. Как относятся друг к другу массы исходных растворов?
Смешивание растворов с разными концентрациями
Пример Сколько граммов хлористого калия надо растворить в 90 г 8%-ного раствора этой соли, чтобы полученный раствор стал 10%-ным?
Концентрирование раствора
Пример Упарили 60 г 5%-ного раствора сульфата меди до 50 г. Определите массовую долю соли в полученном растворе.
Упаривание раствора
Интернет-ресурсы
1. http://www.flogiston.ru
2. http://www.myword.ru
- http://www.psylib.ru
В результате упаривания исходного раствора его масса уменьшилась на Dm г. Определить массовую долю раствора после упаривания w2
Решение
Исходя из определения массовой доли, получим выражения для w1 и w2 (w2 > w1):
w1 = m1 / m
(где m1 – масса растворенного вещества в исходном растворе)
m1 = w1·m
w1 = m1 / (m – Dm) = (w1· m) / (m – Dm)
m = 60 г; Dm = 60 – 50 = 10 г; w1 = 5% (или 0,05)
w2 = (0,05 · 60) / (60 – 10) = 3 / 50 = 0,06 (или 6%-ный)
Какую массу вещества (X г) надо дополнительно растворить в исходном растворе, чтобы приготовить раствор с массовой долей растворенного вещества w2?
Решение
Исходя из определения массовой доли, составим выражение для w1 и w2:
w1 = m1 / m2,
(где m1 – масса вещества в исходном растворе).
m1 = w1 · m
w2 = (m1+x) / (m + x) = (w1 · m + x) / (m+x)
Решая полученное уравнение относительно х получаем:
w2 · m + w2 · x = w1 · m + x
w2 · m – w1 · m = x – w2 · x
(w2– w1) · m = (1 – w2) · x
x = ((w2 – w1) · m) / (1 – w2)
m = 90 г
w1 = 8% (или 0,08), w2 = 10% (или 0,1)
x = ((0,1 – 0,08) ·90) / (1 – 0,1) = (0,02 · 90) / 0,9 = 2 г
Решение
Пусть w1 > w2, тогда w1 > w3 > w2. Масса растворенного вещества в растворе №1 составляет w1 · m1, в растворе №2 – w2 · m2. Масса образовавшегося раствора (№3) – (m1 – m2). Сумма масс растворенного вещества в растворах №1 и №2 равна массе этого вещества в образовавшемся растворе (№3):
w 1 · m1 + w 2 · m2 = w3· (m1 + m2)
w1 · m1 + w 2 · m2 = w3 · m1 + w3 · m2
w 1 · m1 – w3 · m1 = w3 · m2 – w2 · m2
(w1– w3) · m1 = (w3– w2) · m2
m1 / m2 = (w3– w2) / (w1– w3)
Таким образом, массы смешиваемых растворов m1 и m2 обратно пропорциональны разностям массовых долей w1 и w2 смешиваемых растворов и массовой доли смеси w3. (Правило смешивания).
Для облегчения использования правила смешивания применяют правило креста:
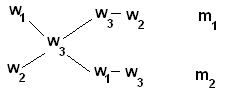
m1 / m2 = (w3 – w2) / (w1 – w3)
Для этого по диагонали из большего значения концентрации вычитают меньшую, получают (w1 – w3), w1 > w3 и (w3 – w2), w3 > w2. Затем составляют отношение масс исходных растворов m1 / m2 и вычисляют.
Пример
Определите массы исходных растворов с массовыми долями гидроксида натрия 5% и 40%, если при их смешивании образовался раствор массой 210 г с массовой долей гидроксида натрия 10%.
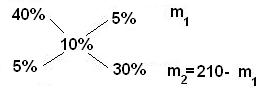
5 / 30 = m1 / (210 - m1)
1/6 = m1 / (210 – m1)
210 – m1 = 6m1
7m1 = 210
m1 =30 г; m2 = 210 – m1 = 210 – 30 = 180 г
Исходя из определения массовой доли, получим выражения для значений массовых долей растворенного вещества в исходном растворе №1 (w1) и полученном растворе №2 (w2):
w1 = m1 / (ρ1 · V1) откуда V1= m1 /(w1 ·ρ1)
w2 = m2 / (ρ2 · V2)
m2 = w2 ·ρ2 · V2
Раствор №2 получают, разбавляя раствор №1, поэтому m1 = m2. В формулу для V1 следует подставить выражение для m2. Тогда
V1= (w2 ·ρ2 · V2) / (w1 · r1)
m2 = w2 ·ρ2 · V2
или
| w1 · ρ1 · V1 | = | w2 · ρ2 · V2 |
| m1(раствор) | m2(раствор) |
m1(раствор) / m2(раствор) = w2 / w1
При одном и том же количестве растворенного вещества массы растворов и их массовые доли обратно пропорциональны друг другу.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 1958; Нарушение авторских прав?; Мы поможем в написании вашей работы!