
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основное и возбужденное состояние атома
|
|
|
|
Состоянии равна 0
Валентность I
s
У атома лития электрон, находящийся на 2 s -подуровне, менее прочно связан с ядром, чем электроны первого энергетического уровня, поэтому в химических реакциях атом лития может легко отдавать этот электрон, превращаясь в ион Li+ (ион - электрически заряженная частица). В этом случае ион лития приобретает устойчивую завершенную оболочку благородного газа гелия:
3Li+ 1 s 2.
Следует заметить, что, число неспаренных (одиночных) электронов определяет валентность элемента, т.е. его способность образовывать химические связи с другими элементами.
Так, атом лития имеет один неспаренный электрон, что обусловливает его валентность, равную единице.
Электронная формула атома бериллия:
4 Bе 1s2 2s2.
Электронно-графическая формула атома бериллия:
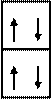 2 Валентность в основном
2 Валентность в основном
s
Легче других у бериллия отрываются электроны подуровня 2 s 2, образуя ион Be+2:
4 Bе+2 1s2.
Можно заметить, что атом гелия и ионы лития 3Li+ и бериллия 4Bе+2 имеют одинаковое электронное строение, т.е. характеризуются изоэлектронным строением.
Состояние атома, при котором его электроны находятся на таких энергетических уровнях, что их суммарная энергия является минимальной, называется основным или невозбужденным. Состояния с более высокими значениями энергии называются возбужденными.
При сообщении атому дополнительной энергии электроны могут переходить на обладающие большей энергией орбитали. Эти переходы с подуровня на подуровень возможны только в пределах одного внешнего энергетического уровня. Происходящее при этом распаривание электронов приводит к возрастанию у атома числа неспа-ренных электронов, т.е. к появлению новых валентных возможностей.
Например, при возбуждении у атома бериллия один электрон с внешнего подуровня 2 s переходит на обладающий большей энергией и ранее свободный (вакантный) подуровень 2 р. При этом валентность атома бериллия становится равной 2.
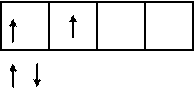
Электронная формула атома бериллия в возбужденном состоянии будет иметь вид:
4 Bе٭ 1s2 2s1 2р1.
Электронно-графическая формула атома бериллия в возбужденном состоянии:
 | |||
 |
 2 Валентность II
2 Валентность II
1 p
s
Электронная формула атома бора в нормальном состоянии:
5B 1 s 22 s 22 p 1.
Электронно-графическая формулаатома бора имеет вид:

|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 18100; Нарушение авторских прав?; Мы поможем в написании вашей работы!