
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Валентность I
|
|
|
|
1 p
s
На втором энергетическом уровне у атома бора 3 электрона, поэтому он образует ион В+3.
Электронная и электронно-графические формулы атома углерода 6С в нормальном состоянии имеют вид:
6С 1s22 s 22 р 2.
 | ||
 |

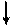 2 Валентность II
2 Валентность II
1 р
s
В возбужденном состоянии атом углерода 6С٭ за счет перехода электрона с орбитали 2 s на орбиталь 2 р будет иметь следующие электронные и электронно-графические формулы:
Электронная формула:
6С٭ 1 s 22 s 12 р 3
Электронно-графическая формула:
 | |||||
 | |||||
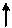 | |||||
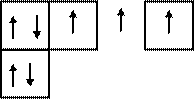 2 Валентность IV
2 Валентность IV
1 р
s
Поэтому, углерод в своих соединениях может быть либо двух-, либо четырехвалентен.
Следует обратить внимание на то, что при возбуждении
могут распариваться электроны только внешнего электронного уровня, если на нем есть свободные орбитали.
У атома углерода внешний энергетический уровень наполовину заполнен, поэтому возможна и отдача 4-х электронов с образованием иона С+4 (1 s 2 2 s 2 2 р 0) и присоединение электронов для максимального заполнения p -подуровня второго энергетического уровня с образованием иона С-4 (I s 2 2 s 2 2 р 6).
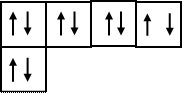
Атом кислорода 8 О 1 s 22 s 22 р 4 имеет на внешнем энергетическом уровне два неспаренных электрона, что обусловливает его валентность, равную двум. Это видно изэлектронно-графической формулы атома кислорода в нормальном состоянии:
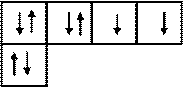
1 p Валентность II
s
Атому кислорода 8О, имеющему на внешнем энергетическом уровне 6 электронов (1 s 22 s 22 р 4) легче достроить внешнюю электронную оболочку, приняв два электрона. При этом у иона кислорода О-2 появляется устойчивая завершенная электронная оболочка благородного газа неона - 1 s 22 s 22 р 6:
 2
2
p
1
s
Второй энергетический уровень имеет два подуровня, поэтому возбуждение для атома кислорода невозможно и валентность атома кислорода имеет постоянное значение, равное двум.
Aтом фтора, образуя соединения с другими элементами, способен принимать только один электрон:
9F 1 s 22 s 22 р 5.
Атом неона имеет на внешнем энергетическом уровне 8 электронов:
10Ne 1 s 22 s 22 р 6.
Такая полностью завершенная (s 2 р 6) оболочка (октет) характеризуется высокой инертностью, поэтому неон - малоактивное вещество, «благородный газ».
Начиная с III периода, у атомов идет заполнение третьего энергетического уровня, имеющего уже три подуровня – s, p и d.
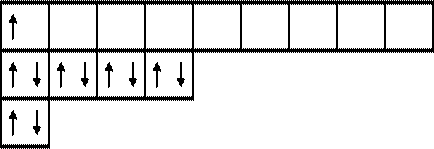
Электронная конфигурация атома натрия, открывающего III период, который характеризуется наличием трех подуровней, будет иметь вид:
11Na 1 s 22 s 22 р 63 s 1.
 | |||
d
p
s
Атом натрия имеет один неспаренный электрон на s подуровне, т.е. является s – элементом и проявляет валентность, равную I.
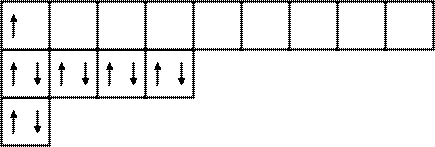
Электронная и электронно-графические формулы атома фосфора (p -электронное семейство) имеют вид:
15 P 1 s 22 s 22 p 63 s 23 p 3,

 3
3
 |  |
2 d
1 p
s
Электронная конфигурация атома кальция (s-электронное семейство):
20Ca 1 s 22 s 22 p 6 3 s 23 p 64 s 2.
Электронно-графическая формула атома кальция:
 |
4
3
d
 2
2
p
1
s
 Следует заметить, что у атома кальция, в соответствии с принципом наименьшей энергии, сначала заполняется подуровень 4 s, а лишь затем подуровень 3 р.
Следует заметить, что у атома кальция, в соответствии с принципом наименьшей энергии, сначала заполняется подуровень 4 s, а лишь затем подуровень 3 р.
Химические свойства атомов определяются, в основном, строением внешних энергетических уровней, которые называются валентными. На подуровнях этих уровней находятся или неспаренные электроны, или электроны, которые могут стать неспаренными в возбужденном состоянии.
Полностью завершенные энергетические уровни обусловливает малую химическую активность обладающих ими атомов.
Часто графически изображают не всю электронную формулу, а лишь те подуровни, на которых находятся валентные электроны (сокращенные электронные и электронно-графические формулы).
Например, для атома серы краткая электронная формула:
16 S …3 s 2 3 p 4
Сокращенная электронно-графическая формула атома серы:
 |
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 2314; Нарушение авторских прав?; Мы поможем в написании вашей работы!