
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Примеры решения задач. Задача 1. По предлагаемым электронным формулам атомов
|
|
|
|
Задача 1. По предлагаемым электронным формулам атомов
а)Is22s22p63s23p64s23dI04p65s1;
б)Is22s22p63s23p64s23dI04p65s24d2;
в)Is22s22p63s23pI
установите элемент, в каком периоде и группе он находится. Какие из них относятся к s-, р-, d- элементам?
Решение. Электронная формула атома "а" заканчивается на 5s1, это значит, что элемент находится в пятом периоде, а наличие 1 электрона на подуровне s определяет его в 1A группу (главную подгруппу) и относит его к семейству s-элементов. Число электронов в электронной формуле определяется зарядом ядра или порядковым номером, следовательно, это атом элемента с порядковым номером 37 - рубидий.
Электронная формула атома "б" заканчивается на …5s 4d2, значит, он находится в пятом периоде, наличие 2 электронов на 4d-подуровне определяет его в 4В группу аналогов (побочная подгруппа четвертой группы)f это d-элемент. А так как число электронов атома "б" равно 40 (определяет порядковый номер элемента (заряд ядра), то это цирконий.
Электронная формула атома "в" заканчивается на 3s23р1, это значит, что атом этого элемента находится в третьем периоде, а так как на внешнем (третьем) уровне находится три электрона (два электрона на s-подуровне и 1 электрон на р-подуровне), то он относится к группе аналогов 3А, главной подгруппе 3 группы. Число электронов в электронной формуле равно 13, что определяется порядковым номером или зарядом ядра, следовательно, это атом алюминия.
Задача 2. Определите порядковый номер элемента, период, группу и возможные окислительные числа, если его электронная формула заканчивается так:[Аr] 4s23d3.
Решение. Запишем полную электронную формулу этого элемента 1s2
2s22p63s23p64s23d3; т.к. электронная формула заканчивается
на 4s23d3, это значит, что атом данного элемента находится в 4 периоде, наличие 3 электронов на d-подуровне третьего уровня и 2 электронов на 4s-подуровне четвертого уровня относит этот элемент к группе аналогов 5В, т.е. к пятой группе побочной подгруппы. Число электронов в электронной формуле (23) соответствует порядковому номеру элемента (или заряду ядра); следовательно, это элемент ванадий.
Распределим электроны внешнего и застраивающегося d подуровня по ячейкам:
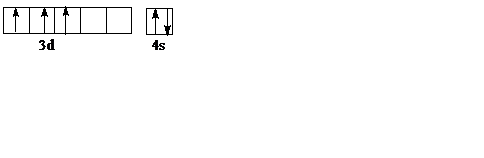
Возможные окислительные числа ванадия 2,3,4,5.
Задача 3. Указать группы и подгруппы, для которых характерны
конфигурации: a) s2р4; б) d3s2; в) 3р64s1. Какие конфигурации
относятся к металлам, какие - к неметаллам?
Решение. а) конфигурация s2р4 соответствует шестой группе, главной
подгруппе или группе аналогов 6А - эта группировка
относится к неметаллам;
б) конфигурация d3s2 соответствует пятой группе, побочной
подгруппе или группе аналогов 5В, такая конфигурация
относится к металлам;
в) конфигурация 3р64s1 соответствует первой группе
главной подгруппы или группе аналогов 1A, такая
конфигурация относится к металлам.
Задача 4. Известно, что энергия, необходимая для удаления электрона
из иона Р4+, равна 6270 кДж/моль, тогда как для удаления
электрона из иона Si4+ требуется энергия 16100 кДж/моль.
Объясните причину столь большого различия.
Решение. Атом фосфора имеет конфигурацию внешних электронов
3s23p3.
После удаления четырех из этих электронов самую высокую
энергию из оставшихся электронов имеет 3s - электрон. Конфигурация внешних электронов в атоме кремния 3s23p2. После удаления этих четырех электронов самую высокую энергию из оставшихся электронов имеет 2р-электрон. Поскольку 3s-электрон фосфора находится главным образом за пределами устойчивого остова Is22s22р6 электронов, то для его удаления требуется намного меньшая энергия, чем для удаления электрона с 2р-подуровня, как у кремния.
Задача 5. Какова взаимосвязь между величиной атомного радиуса
зарядом ядра и электронным строением атома и как она
влияет на средний размер радиуса атома?
Решение. Радиус конкретного атома в молекуле изменяется в
зависимости от числа и расположения вокруг него других
атомов и от степени ионности образуемых при этом связей. Атомный радиус возрастает при увеличении главного квантового числа. Однако средний радиус электронного распределения для каждого энергетического уровня в различных атомах неодинаков и зависит от эффективного заряда ядра. Под эффективным зарядом ядра Zэфф. понимается кажущийся заряд, который действует на рассматриваемый электрон. Величина Zэфф. меньше, чем истинный заряд ядра Z, потому что каждый внешний электрон частично экранируется от действия ядра внутреннимиэлектронами. Для внешних электронов степень экранирования другими электронамиэтого же атома илииона характеризуется постоянной экранирования S, которая определяется как разность между истинным и эффективным зарядом ядра, отсюда Zэфф. = Z-S. Электроны каждого уровня слабо экранируются другими электронами этого уровня, но существенно экранируются электронами, находящимися на более глубоких уровнях. Чтобы раccчитатьS, пользуются следующими эмпирическимиправилами.
1. Электроны на более высоких энергетических уровнях, чем рассматриваемый электрон, не дают никакого вклада в экранирование.
2. Каждый электрон, находящийся на том же энергетическом уровне, что и рассматриваемый электрон, дает вклад в S -0,35.
3. Каждый электрон на предшествующем внутреннем уровне вносит вклад в S - 0,85; однако если рассматриваемый электрон относится к d-илиf-типу, вклады от электронов предшествующего уровня считаются равными единице.
4. Вклады в постоянную от электронов, находящихся на еще более глубоких энергетических уровнях, полагаютсяравными единице.
Примеры вычисления S и Zэфф для самого внешнего электрона атома:
3Li 1s22s1Zэфф. = Z-S = 3-(2∙0,85) = +1,30
19K 1s22s22p63s23p64sI Zэфф. =19-(8∙0.85)-(10∙1,00)=+2,20
55Cs 1s22s22p63s23p63d104p65s24d105p66s1
Z эфф. =55-(8∙0,85) - (46∙1,00) = +2,20
Вывод. Для всех элементов одной группы Zэфф., действующий на самые внешние электроны, приблизительно одинаков. Поэтому размеры атомов зависят восновном от числа энергетических уровней, заселенных электронами.
Внутренние электроны на более глубоких энергетических уровнях экранируют внешний электрон от действия ядра. Во всех элементах первой группы главной подгруппы (1А) величина Zэфф., действующего на самый внешний электрон атома, примерно одинакова.
При переходе к элементам той же подгруппы с большими порядковыми номерамии высокими Z средний радиус распределения электронов для каждого энергетического уровняпоследовательно уменьшается, но из-за появленияновых энергетических уровней общий радиус атомаувеличивается.
В периоде по мере добавления новых электронов на частично заселенный энергетический уровень появление новых протонов в атомном ядре постепенно увеличивает Zэфф., а средний радиус распределения электронов на этом уровне уменьшается.
При переходе слева направо вдоль каждого периода радиус атомов постепенно уменьшается.
Задача 6. Укажите, какизменяется энергия ионизации атома при
перемещении слева направо в любом периоде и сверху вниз в
любой группе периодической таблицы.
Решение. Мерой ионизации является потенциал ионизации - то
наименьшее напряжение поля в вольтах, при котором
скорость электронов становится достаточной для ионизации
атома. При затрате достаточной энергии можно оторвать от
атома два, три и более электронов. Поэтому говорят о первом
потенциале ионизации (энергия отрыва от атома первого
электрона), втором, третьем и т.д.
Ионизируемым является тот электрон, для которого энергия ионизации минимальна; 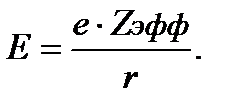
Потенциал ионизации тем больше, чем больше эффективный заряд ядра и чем меньше средний радиус распределения электрона. Рассмотрим, какизменяется потенциал ионизации в периоде слева направо и в группе сверху вниз. При движении слева направо вдоль одного периода происходит одновременное возрастание заряда ядра и увеличениечисла электронов, компенсирующее возрастание заряда ядра. Однако новые электроны не полностью экранируют внешние электроны от действия ядра, что приводит к последовательномуповышению эффективногозаряда ядра, уменьшению радиуса атома и увеличению потенциала ионизации. Однако это возрастание происходит не всегда равномерно, иногда потенциал ионизации становится меньше по величине, чем у предыдущего элемента того же периода. Например, у атома бора J меньше, чем у атома Be. Это объясняетсябольшим проникновением 5s-электроновк ядру по сравнению с р-электронами того же энергетического, уровня.При ионизациибериллия с электронным строением 1s22s2 происходит отрыв от атома 2s- электрона, а при ионизации бора, имеющего электронную конфигурацию 5В 1s22s22р1 - 2р- электрона. Это же наблюдается при переходе от 12Mg к13Al (третий период) от 30Zn к 31Ga(четвеpтый период)
В рассматриваемых примерах на величину потенциала ионизации влияет эффектпроникновения. Из квантово-механическихрасчетов известно, что при одинаковом значении главного квантового числа nнаиболее проникающими кядру являются s > p > d > f- электроны.
Проследим, как влияет "эффект отталкивания"электронов на величину энергии ионизации в периоде слева направо. Сравним, как происходит ионизация у пары азота и кислорода. У атома кислорода, имеющего электронную конфигурацию 1s22s22p4, ионизация электрона происходит с заполненного р-подуровня. Отталкивание между двумя р-электронами, находящимися в атоме кислорода на одной орбитали, так велико, что, несмотря на увеличение эффективного заряда ядра и уменьшение радиуса атома, отрыв от этих р-электронов осуществляется легче, чем отрыв от атома азота, имеющего наполовину заполненный р-подуровень 7N 1s22s22p3, поэтому энергия ионизации кислорода будет меньше, чем атома азота. Это же наблюдается при отрыве 15P к 16S от 33As к 34Se.
Рассмотрим влияние эффектов экранирования на величину энергии ионизациианалогов р- и, s- элементов 5 группы:
| 5А Аs Sb 5Bi | 5B V Nb Ta |
| J,эВ 9,81 8,64 7,29 | J,эВ 6,746,88 7,88 |
У атомов элементов 5А группы наблюдается уменьшение энергии ионизации от As кBi, что объясняется увеличением влияния эффекта экранированияи стабильностью эффективногозаряда ядра.
У атомов элементов группы аналогов 5В наблюдается увеличение значения величин энергии ионизации от V к Та, что объясняется увеличивающимся эффектом проникновения внешних s-электронов к ядру.
Задача 7. Объясните, почему сродство к электрону для атома азота
имеет большее положительное значение, чем для углерода.
Решение. Энергетический эффект (ккал, кДж), отнесенный к грамм-
атому элемента, при присоединении электрона к
газообразному (изолированному) атому или иону называется
сродством к электрону (Е).
M(г) + ē = М-(г). Для большинства нейтральных атомов и всех положительно заряженных ионов присоединение электрона сопровождается выделением энергии, поэтому сродство к электрону Р имеет отрицательную величину. Е тесно связано с J (потенциалом ионизации). Сродство к электрону ε для однозарядного положительного иона противоположно по знаку, но совпадает по величине с энергией ионизации соответствующего нейтрального атома. В целом при перемещении слева направо вдоль одного периода сродство к электрону принимает все более отрицательные значения (что соответствует увеличению способности атома притягивать электрон). Самые большие отрицательные значения ε характерны для галогенов, элементов группы 7А, но значения эти мало отличаются друг от друга. При переходе от фтора к йоду присоединяемый электрон поступает на р-орбиталь со все большим значением главного квантового числа. Среднее paсстояние электрона от ядра на этой орбитали тоже последовательно возрастает, а притяжение между электроном и ядром должно уменьшаться. Так как размеры орбиталей, на которых находятся внешние электроны в атомах галогенов, при переходе от фтора к йоду последовательно увеличиваются, отталкивание между находящимися на них электронами и добавляемым электроном с ростом атомного номера галогена должно уменьшаться. Чем меньше притяжение к ядру добавляемого электрона, тем меньше и отталкивание между внешними электронами, в результате величины значений сродства к электрону для всех галогенов оказываются близкими. Аналогичная закономерность в значениях сродства к электрону наблюдается и для элементов других групп периодической системы.
 Отвечая на вопрос поставленной задачи, распределим электроны внешнего слоя атома углерода по орбиталям, если электронная формула его такова: 1s22s22p2; присоединяемый к атому электрон
Отвечая на вопрос поставленной задачи, распределим электроны внешнего слоя атома углерода по орбиталям, если электронная формула его такова: 1s22s22p2; присоединяемый к атому электрон
 может заполнить имеющуюся в нем вакантную 2р-орбиталь. В отличие от этого атом азота имеет полузаполненный 2р- подуровень,
может заполнить имеющуюся в нем вакантную 2р-орбиталь. В отличие от этого атом азота имеет полузаполненный 2р- подуровень,
в котором на каждой 2р-орбитали уже находится по одному электрону. Следовательно, присоединяемый к атому азота дополнительный электрон должен попасть на орбиталь, занятую одним электроном. Отталкивание, возникающее между двумя электронами на одной орбитали, является причиной того, что атом азота обладает меньшей способностью притягивать дополнительный электрон, чем атом углерода. Следовательно, атомы элементов с заполненными или полузаполненными подуровнями имеют более положительное сродство к электрону (меньшую способность притягивать электрон), чем элементы, соседние с ними в периодической таблице.
Задача 8. Вычислите энергию ионизации калия в кДж/моль, если первый по-
тенциал ионизации (J1) его равен 4,34 В.
Дано:
Для атома К J1=4,34В
N =6,02 1023
J=?
Решение. Энергия ионизации эВ/атом численно равна его ионизационному
потенциалу, выраженному в вольтах. I эВ=1,602∙10-19Дж. Эту ве-
личину можно выразить в моль атомов: произведение потенциала
ионизации (4,34 В) на число Авогадро (N) дает нам величии -
энергии ионизации.
J=4,34∙1,602 ∙10-19∙ 6,02 ∙1023 = 418,5 кДж/моль
Задача 9. Вычислите относительную электроотрицательность брома,
если известна энергия ионизации брома, равная 1140,8 кДж/моль,
и сродство к электрону -3,54 эВ/атом.
Дано:
JBr = 1140,8 кДж/моль
Еср = 3,54 эВ/атом
ОЭО=?
Решение. Электроотрицательность элемента ОЭО - это мера его
неметалличности. Она характеризует способность атома
элемента присоединять электроны при образовании
химической связи. Электроотрицательность (ОЭО) определяется как арифметическая сумма энергии ионизации и сродства к электрону, т.е. ОЭО = (J + E). Сродство брома к электрону равно
Е = 3,54∙1,602∙10-19∙6,02 1023= 341,4кДж/моль.
Задача 10. Как объяснить характер изменения сродства к электрону у атомов галогенов: 3,62 (F), 3,82 (CI), 3,54(Br), 3,24 эВ (J)?
Решение. Уменьшение сродства к электрону от хлора к йоду связано с увеличением радиуса атома и количества электронных слоев.
4. ХИМИЧЕСКАЯ СВЯЗЬ
Природа химической связи электрическая
В зависимости от характера распределения электронной плотности в веществе различают три основных типа химической связи; ковалентную, ионную, металлическую.
Главную роль в межатомных взаимодействиях играют те электроны, которые связаны в атоме наименее прочно. Эти электроны обусловливают возникновение химических (валентных) связей между атомами при образовании молекул. Их называют валентными.
Квантово-механические расчеты показывают, что взаимодействовать (вступать в связь) могут только те атомы, у которых имеются неспаренные электроны.
Если в нормальном состоянии (невозбужденном) на внешнем уровне атома нет спаренных электронов, то при затрате сравнительно небольшой энергии извне в пределах одного и того же уровня происходит процесс разъединения электронной пары. Например, возбуждение может произойти из s- состояния в р-состояние, из р- в d- состояние.
Нормальное состояние Возбужденное состояние
4Ве 1s22s2 4Ве* 1s22s12p1 
17CI ls22s22p63s23p5 C1* 3 2Зр43d1 число непарных
электронов – 3
Для атома хлора возможны следующие возбуждения
Нормальное
состояние:
| Первое возбужденное состояние, число непарных электронов -3 |


| Второе возбужденное состояние, число непарных электронов-5 |

3s23р33d2
| Третье возбужденное состояние, число непарных электронов-7 |

3s13р33d3
Способность каждого элемента к образованию химических связей называется валентностью. Валентность хлора в нормальном состоянии равна 1, при С1*- 3, при Cl** - 5, при Cl*** - 7. Химическая связь в основном осуществляется так называемыми валентными электронами. У s- и р-элементов валентными являются электроны внешнего слоя, а у d-элементов - электроны s-состояния внешнего слоя и d- состояния предвнешнего слоя.
4.1. Ковалентная связь
Ковалентная связь сосредоточена между двумя атомами, она двухцентровая, двухэлектронная и осуществляется одной или несколькими общими электронными парами.
Ковалентная связь может образоваться по обменному и донорно-акцепторному механизмам.
Обменный механизм: электронные облака непарных электронов, взаимно перекрывая друг друга, образуют общие электронные облака (молекулярные) с более высокой электронной плотностью, например, Сl2, N2, H2O, HCI. Например, при образовании молекул Cl2, N2 образуются общие электронные облака (одно, три), симметрично располагающиеся в пространстве относительно обоих ядер атомов, связь неполярна. 
В случае образования молекул HCl, H2O и других общие электронные облака несимметричны и смещены к более электроотрицательному элементу Cl, 0; связь полярна. 
Электронные облака атомов, как показано ниже, имеют различную форму (см. 2.1), поэтому их взаимное перекрывание может осуществляться разными способами.
| : |
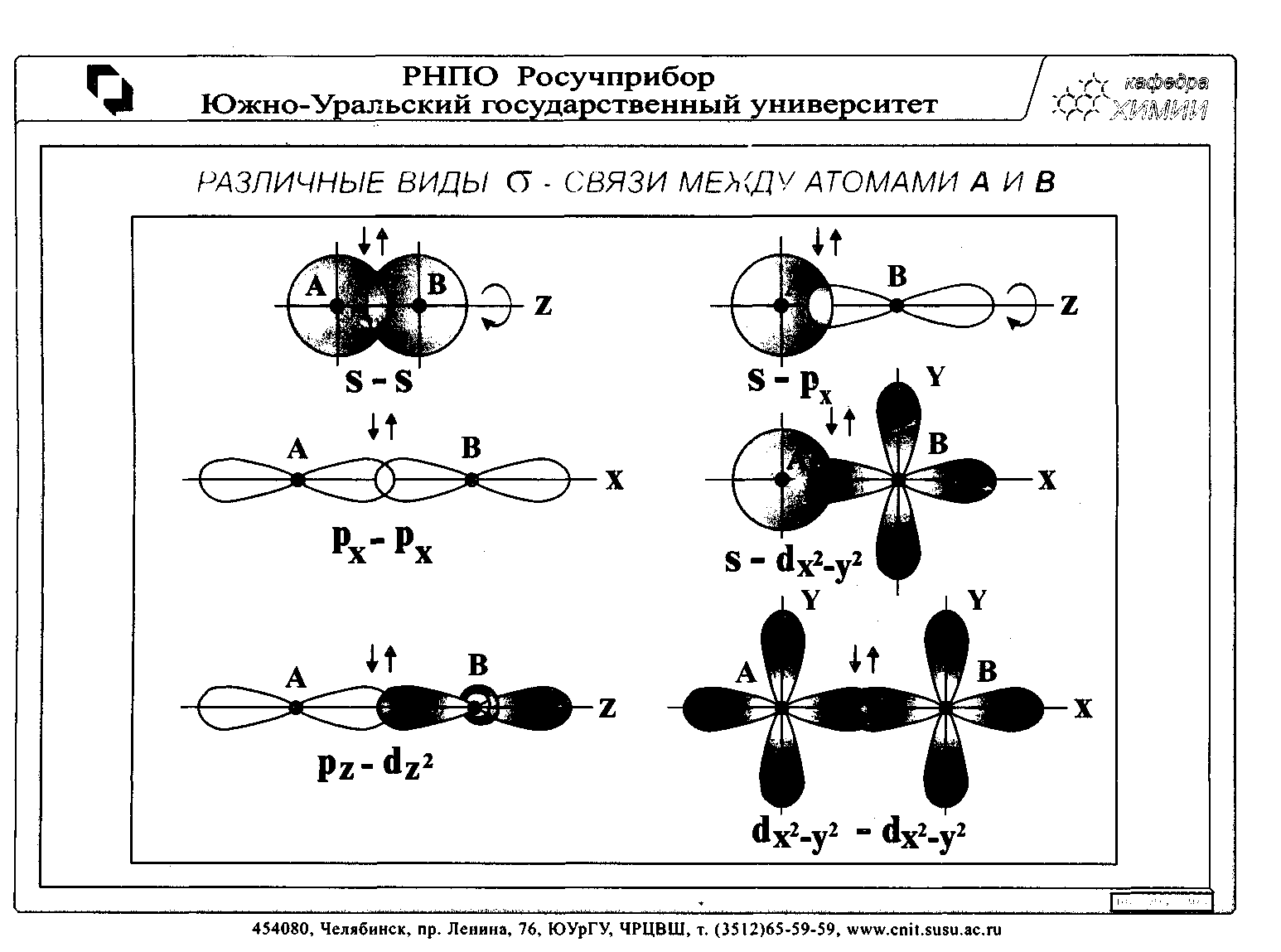
π-связь образуется за счет взаимного перекрывания электронных облаков перпендикулярно линии соединения центров ядер (σ).
| : |
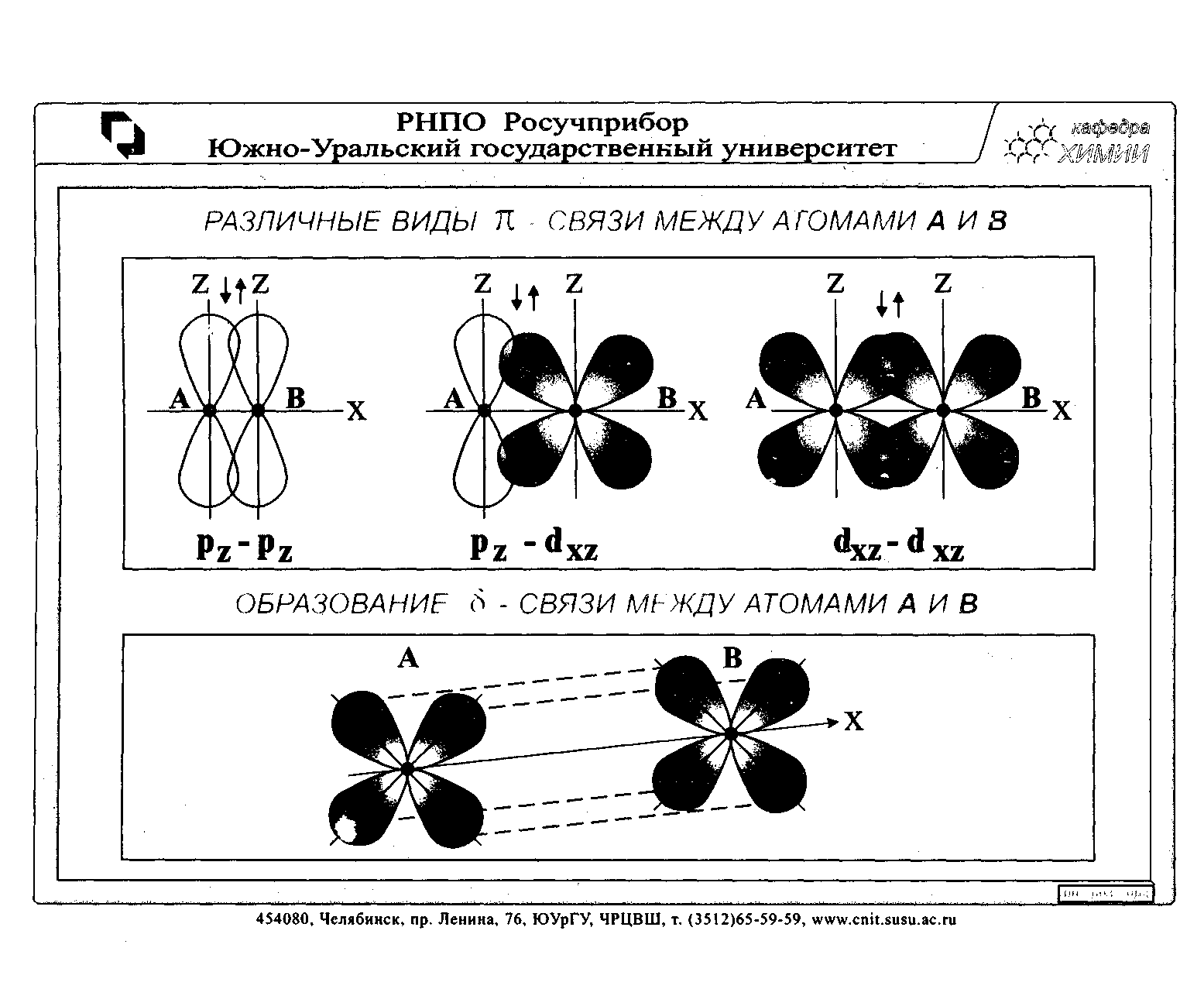
К ним относятся связи πp-p; πd-d; πd-f; πf-f . S-орбитали не принимают участия в образовании π-связи, δ(дельта)-связи встречаются в соединениях между атомами переходных элементов, например в ионе (Re2Cl8)2-.
| : |

На этом рисунке приведены схемы перекрывания двух атомных d-орбиталей, расположенных в параллельных плоскостях.
Донорно-акцепторный механизм (ДАМ). В этом случае различают атом-донор, представляющий при образовании связи двухэлектронное облако, и атом-акцептор: имеющий свободную орбиталь.
Рассмотрим образование иона NH4+ из молекулы аммиака и -катиона водорода, имеющего свободную орбиталь. Атом азота в молекуле аммиака имеет неподеленную 2s-электронную пару (донор), а катион водорода - свободную орбиталь (акцептор):

В ионе аммония атом азота образует три ковалентных N-Н-связи путем перекрывания 3 одноэлектронных р - облаков азота с 3 электронами 3 атомов водорода, а четвертая N-Н связь образуется по ДАМ. Ковалентную связь, образованную по ДАМ,условно обозначают стрелкой ( ).
).
4.2. Свойства ковалентной связи
Насыщаемость: молекулы имеют определенный состав и существуют в виде дискретных частиц с определенной структурой за счет
насыщаемости. Атом углерода в СН4 может принимать (перекрываться) только с четырьмя атомами водорода. Здесь насыщены четыре валентности углерода и валентности четырех атомов водорода. Бор благодаря этому свойству четырех насыщаем, атом бора в возбужденном состоянии имеет только три непарных электрона и одну свободную р – орбиталь:
5B  – 1s22s22p1
– 1s22s22p1
5B*2s12p2 
При образовании иона ВН4- возбужденный атом бора образует 3 В-H -связи по обменному механизму, а четвертая связь образуется за счет свободной р-орбитали атома бора и неподеленной электронной пары гидрид иона (:Нˉ).
В этом ионе атом бора - акцептор, а гидрид ион:H-- донор.
Направленность связи определяется формой электронных облаков и различными способами их взаимных перекрываний. Для молекул типа АА, АВ, Н-Н, H-Cl направленность имеет линейный характер. У них возникает одна одинарная связь (σ-связь) -перекрывание облаков происходит в направлении прямой, соединяющей ядра атомов.
Молекулы А2В, в которых центральный атом В участвует двумя р-электронами в образовании ковалентных связей, располагающихся в пространстве под углом 90°, имеют угловую или пирамидальную направленность, как в молекулах H2O, NH3.
Между атомами может осуществляться кратная связь, двойная или тройная. В молекуле азота р-электроны внешнего слоя в каждом из атомов расположены по осям Рх, Ру, Рz, между атомами азота образуются одна σ-связь по линии, соединяющей ядра атомов, и две π-связи путем перекрывания Ру, Рz облаков обоих атомов, направленных перпендикулярно линии направления σ -связи.
Поляризуемость связи. Для характеристики реакционной способности молекул важно знать не только исходное распределение электронной плотности, но и ее поляризуемость. Поляризуемость характеризует способность связи становиться полярной или более полярной в результате действия на молекулы внешнего электрического поля. В результате поляризации может произойти полный разрыв связи с переходом связывающей электронной пары к одному из атомов с образованием отрицательного и положительного ионов. Это гетеролитический разрыв (ионизация).

При гомолитическом разрыве разрушается связывающая электронная пара и HCl распадается на атомы.
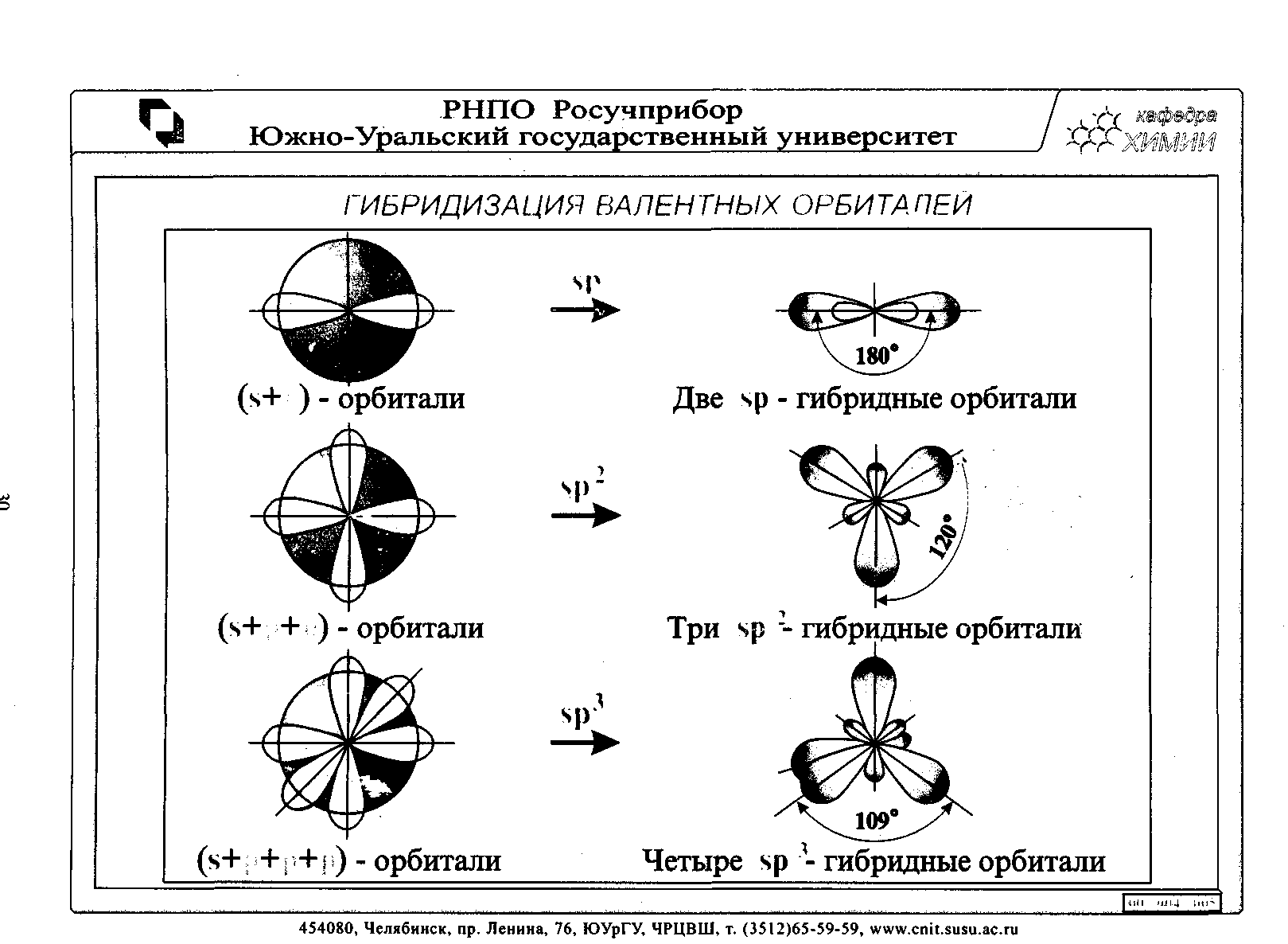
4.3 Гибридизация атомных орбиталей
Гибридизация осуществляется в центральном возбужденном состоянии атома.
Очень часто атомы образуют связи за счет электронов разных энергетических состояний. Например, у возбужденного атома бериллия Be* (2s12р1) в образовании связи участвуют один s- и один р-электроны внешнего слоя; у возбужденного атома бора (2s12p2) –один s- и два р-электрона. В этом случае происходит так называемая гибридизация: первоначальная форма электронных облаков (орбиталей) взаимно изменяется и образуются облака (орбитали) новой, но уже одинаковой формы (q). На рисунке показан вид гибридного облака,возникающего при комбинации облаков s- и р-электронов. Гибридное облако имеет бóльшую вытянутость по одну сторону от ядра, чем по другую.
Электроны s- и р-подуровней переходят, таким образом, на некоторый средний энергетический более выгодный гибридный подуровень. Гибридизация связана с энергетическим выигрышем за счет образования более прочных связей, более симметричного распределения электронной плотности. Различают sp, sp2, sp3, sp3d1-2-гибридизацию: BeCl2, BCl3 СН4, SF6. sp – гибридизация в центральном атоме Be в молекуле BeCl2. 4Be 1s22s2;
Be*1s22s12p1; Be* 
2s 2p
|
| p |
| SP |
| Две SP - |
| SP |
| SP2 |
| sp |
| Две sp |
| sp |
| (s+p) ) |
Комбинация одной s- и одной p– орбиталей приводит к образованию двух гибридных орбиталей расположенных под углом 1800; sp2–гибридизация в центральном возбужденном атоме бора.


|
| 3q |
| sp2 |
| Три sp2 - гибридные орбитали |
| S+p+p |
| Три SP2- |
| (S+P+P) |
Под таким же углом располагаются и связи, образованные в молекулах (BF3, BCl3, GaCl3);
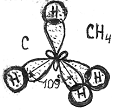
sp3 – гибридизация проявляется в возбужденном атоме углерода в молекулах (СH4, СF4).
Комбинация одной s- и трех p– орбиталей приводит к образованию четырех гибридных орбиталей (4q), расположенных под углом 109028′.
| 109028’ |
| sp3 |
| (S+P+P+P) |
| Четыре SP3 |

|
Ковалентная связь в зависимости от симметричности расположения общих электронных пар внутри молекулы делится на два вида: полярную и неполярную.
Неполярная связь характеризуется тем, что общая электронная пара с одинаковой силой притягивается ядрами обоих атомов, она находится на одинаковом расстоянии от ядер обоих атомов. Центры тяжести положительных зарядов ядер и отрицательных зарядов электронов совпадают в одной точке, поэтому такие молекулы называются неполярными. Этот вид ковалентного типа связи имеет место между атомами в молекулах простых веществ, например, хлора, азота, кислорода.
Полярная связь - самая распространенная форма связи. Она осуществляется при соединении атомов разных элементов. Полярная ковалентная связь - характеризуется тем, что, электронная плотность перекрывающих друг друга облаков (электронная пара) тяготеет к одному из атомов, к более электроотрицательному атому (более неметаллическому элементу), который взаимодействует с электронной парой более энергично, чем другой, и смещает электронное облако к себе. Смещение электронного облака называется поляризацией. В результате такого смещения электронной пары к одному из атомов электрические заряды в молекуле распределяются неравномерно, поэтому центры тяжестей электрических зарядов в молекуле не будут совпадать в одной точке, между ними появится некоторое расстояние l, называемое длиной диполя,например, молекулы HCl, H2O называются полярными или дипольными. Чем больше будет длина диполя, тем более полярной является молекула. Для определения степени полярности молекулы или степени асимметрии расположения электронов в поле ядра пользуются величиной дипольного момента μ, который представляет собой произведение заряда электрона ē на длину диполя.
Заряд электрона имеет величину порядка 10-10 эл.ст.ед., а длина диполя - величину порядка диаметра атома, т.е. 10-8см. Дипольный момент – это векторная величина, рассчитываемая для электрического диполя по формуле μ=е·l; е - эффективный заряд; l длина диполя-вектор направленный от центра отрицательного заряда к центру положительного заряда выражается величинами порядка 10-18 эл.ст.ед.см (10-8∙10-10).Эту величину называют единицей Дебая Д (1 дебай равен 10-18эл.ст.ед.см). Постоянные дипольные моменты молекул имеют значения от 0 до 10 Д. У неполярных молекул μ = 0.
Ионная связь это предельный случай полярной ковалентной связи, образуется при взаимодействии атомов элементов, сильно отличающихся по электроотрицательности (типичные металлы с активными неметаллами), например, NaCl, KBr. Атом металла за счет оттягивания электронной плотности к атому с большей ЭО превращается в положительно заряженный ион (+), а атом неметалла - в отрицательно заряженный ион (-). Разноименно заряженные ионы металла и неметалла притягиваются друг к другу зa счет электростатических сил по закону Кулона.
Ненаправленность и ненасыщаемость ионной связи
Электрические заряды ионов определяют стехиометрический состав соединений, так как разноименные заряды ионов обусловливают их притягивание и отталкивание.
|
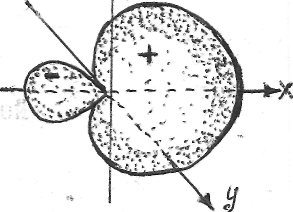
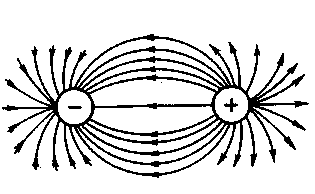
Силовые поля ионов равномерно распределяются во всех направлениях в пространстве и поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении, поэтому ионная связь характеризуется ненаправленностью (рис.1).
Рис.1.Распределение электрических силовых полей двух разноименных ионов
Взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей. Вследствие этого у ионов сохраняется способность притягивать ионы противоположного знака и по другим направлениям, следовательно, ионная связь характеризуется ненасыщаемостью (рис.1).
Структура ионных соединений
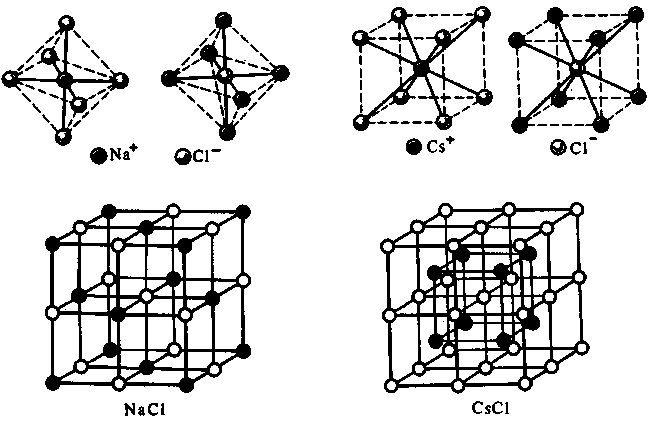
Координационное число (к.ч.) «чисто» ионных соединений не зависит от электронной структуры атомов элементов, а определяется соотношением размеров ионов, т.е. радиусов. Так, при соотношении ионных радиусов в пределах от 0,41÷0,76 имеет место октаэдрическая координация; при соотношении 0,73÷1,37 – кубическая.
Например, радиус иона Na+ = 0,098 нм; радиус иона Cl– = 0,181 нм; отношение rNa+/rCl–=0,098:0,181=0,54–возникает октаэдрическая координация (рис. 2).
Соотношение ионных радиусов Cs+ = (rCs+ = 0,165 нм) и Cl– (rCl– = 0,181нм) равно 0,91, что соответствуеут кубической координации (рис.3).
|
Рис. 2. Структурный тип Рис.3. Структурный тип
хлорида натрия NaCl хлорида цезия CsCl
Следовательно, ионные соединения представляют собой кристаллические вещества и поэтому для них понятие простых двух ионных молекул (NaCl, CsCl) теряет смысл: кристалл состоит из огромного числа ионов и их формулы можно написать так: NanCln, CsnCln.
Металлическая связь - сильно нелокализованная химическая связь. Небольшое число электронов одновременно связывает большое число атомных ядер, а сами электроны перемещаются в кристаллической решетке металла.
Пример: атом лития, имеющий электронную конфигурацию 1s22s22р0, на внешнем уровне имеет четыре орбитали и один электрон; литий кристаллизуется в объемно-центрированной решетке. Каждый атом в кристаллической решетке имеет по восемь соседних атомов и в кристалле лития орбитали соседних атомов перекрываются. Каждый атом лития предоставляет на связь четыре валентные орбитали 2s _ и 2р _ _ _ и один валентный электрон. Всего в монокристалле с такой упаковкой будет 36 орбиталей (9·4=36) и 8 электронов.
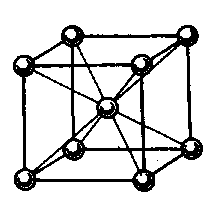
Рис.4. Взаимная координация атомов в кристалле лития
Известно, что атомы металла характеризуются малой энергией ионизации и валентные электроны слабо удерживаются в атоме и легко перемещаются из одной орбитали в другую. Таким образом, электроны принимают участие в образовании связи между атомами кристалла металла. Перемещение электронов по кристаллу определяют электрическую проводимость металла. Металлическая связь сильно делокализована.
Исходя из сказанного, металл можно рассматривать как плотноупакованную структуру из положительно заряженных ионов, связанных друг с другом коллективизированными электронами (электронным газом).
Водородная связь. Атом водорода, вступая в соединение полярного типа, не утрачивает своей реакционной способности, обладая очень малыми размерами, создает электрическое поле высокой напряженности. Ничтожно малый по размеру положительно поляризованный атом водорода глубоко внедряется в электронную оболочку соседнего отрицательно поляризованного атома, образуя связь, называемую водородной. Водородная связь образуется за счет сил электростатического и донорно-акцепторного взаимодействий. Положительно поляризованный катион водорода выступает в роли акцептора. Так, молекула воды может образовать четыре водородных связи за счет двух атомов водорода и двух несвязывающих электронных пар атома кислорода. Водородная связь обозначается тремя точками. Водородная связь играет важную роль при ассоциации молекул, в процессе кристаллизации, растворения, образования кристаллогидратов.

Ассоциация молекул воды водородной связью (…)
4.4. Межмолекулярное взаимодействие
Связи сцепления, действующие между молекулами, известны как ван-дер-ваальсовы силы (по имени голландского ученого). Они проявляются между молекулами веществ в любом агрегатном состоянии: газообразном, жидком и твердом.
Ван-дер-ваальсовы силы действуют на очень малом расстоянии, примерно 10-7 см. Природа этих сил электрическая: заряды одной молекулы взаимодействуют с противоположными зарядами другой. Ван-дер-ваальсовы силы состоят из трех видов взаимодействия: ориентационного, индукционного и дисперсионного.
Ориентационное взаимодействие наблюдается между полярными молекулами. Диполи разных молекул, совершая тепловое беспорядочное движение, при сближении ориентируются своими разноименными полюсами, в результате возникают ассоциаты.
Индукционное взаимодействие основано на явлении поляризации. Под влиянием полярных молекул неполярные и малополярные молекулы деформируются, возникает наведенный индуцированный диполь. Этот эффект приводит к силам взаимодействия молекул, называемым индукционными.
Возникновение у неполярных молекул мгновенного диполя в каждый момент времени, вследствие несимметричного в данный момент расположения зарядов внутри молекулы, приводит к возникновению сил взаимодействия молекул, которые называются дисперсионными. Дисперсионная составляющая притяжения универсальна и присутствует всегда. Наиболее отчетливо дисперсионное притяжение проявляется при взаимодействии неполярных молекул и взаимодействии атомов благородных газов.
Ван-дер-ваальсовы силы значительно уступают по величине химическим силам, однако они обеспечивают относительно прочные связи. Ван-дер-ваальсовы силы - силы притяжения молекул друг к другу.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 3391; Нарушение авторских прав?; Мы поможем в написании вашей работы!