
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Задачи для самостоятельного контрольного решения
|
|
|
|
ТРЕБОВАНИЯ К ЗНАНИЯМ И РЕКОМЕНДАЦИИ
Изучив предлагаемый раздел химии, студент должен:
1. Знать корпускулярно-волновые свойства электрона, причину возникновения спектра атома. Уметь определять массу, длину волны, частоту, энергию электрона в атоме.
2. Знать квантовые- числа, принципы Паули и наименьшей энергии, уметь определять число орбиталей и электронов на подуровне и уровне, изображать электронные формулы атомов.
3. Знать периодическую систему элементов и периодический закон Д.И.Менделеева. Уметь объяснять периодичность изменения химических свойств элементов на основе положения их в таблице, используя величины радиусов атомов, энергии ионизации и сродства к электрону.
4. Уметь объяснить: природу химической связи, валентность, способы образования и свойства ковалентной связи. Гибридизацию валентных орбиталей, геометрию молекул, ионную, металлическую, водородную связи.
5. Уметь объяснить свойства веществ на основе межмолекулярного взаимодействия и типa химической связи.
6. Уметь рассчитывать изменение энтальпии реакции по энергии связи; энергию, длину и дипольный момент связи.
Рекомендации к выполнению контрольной самостоятельной работы
1. Изучить теоретический материал, используя конспекты лекций, рекомендуемую литературу и данное учебно-методическое пособие.
2. Проработав внимательно теорию и предложенные задачи с решениями, проверить усвоенные теоретические знания, выполнив варианты предложенных задач.
1. Каким линиям в спектре отвечает излучение водорода при переходе электрона из одного энергетического состояния в другое со следующими начальными и конечными значениями главного квантового числа: n =4 и 2;n= 3 и 2; 1?
Какой области электромагнитного спектра отвечают эти линии?
2. Определите энергетические переходы электрона атома водорода, соответствующие красной (λ=658 нм) и голубой (λ=482 нм) линиям в спектре испускания.
3. Рассчитайте, с какой скоростью должны двигаться электрон, нейтрон и частицы массой 1г, чтобы соответствующая длина волны де Бройля составляла 0,15 нм?
4. Свет с длиной волны 5000А0 (5∙10-5 см) соответствует зеленой части видимого спектра. Вычислите волновое число, отвечающее этой длине.
5. Свет с длиной волны 5∙10-5 см соответствует зеленой части видимого спектра. Вычислите энергию фотона зеленого света в кДж. Сколько кДж приходится на моль фотонов зеленого света?
6. Вычислите волновые числа ν для линий, характеризующиеся значением n1 = 1 и n2 = 2,3 и 4.
7. Какой длиной волны характеризуется электрон, движущийся со скоростью, равной 1/10 скорости света? Масса электрона равна 9,11∙10-28 г.
8. С какой скоростью должен двигаться электрон, чтобы его де бройлева длина волны была равна 3,32∙10-10 м?
9. Нейтроны, движущиеся с кинетической энергией в интервале от 8,0∙10-21 до 1,6∙10-20Дж, используют для изучения структуры молекул. Каковы длины волн такого "излучения"? Сравните вычисленные вами длины волн с размерами молекул (от 10-8 до 10-10м). Масса нейтрона 1,67∙10-24 г.
10. а)Какой частотой характеризуется фотон с энергией 1,45∙10-19Дж?
б) Если энергия фотона с длиной волны 535 нм полностью перейдет в теплоту, то во сколько раз больше калорий выделится при этом превращении, чем при превращении в теплоту энергий фотона с длиной волны 0,15 н.м?
11. В спектре ртути имеется интенсивная синяя линия с длиной волны 4,358∙10-7 м.
а) Какова энергия фотона с такой длиной волны?
б) Какова энергия одного моля таких фотонов в кДж/моль?
12. Большая часть солнечного излучения с длиной волны ниже 400 нм поглощается земной атмосферой частично благодаря наличию в ней озона. Какова частота и энергия фотона с длиной волны 400 нм?
13. Гигантские радиотелескопы, "прослушивающие" излучение дальнего космоса, обнаружили сильные радиосигналы с длиной волны 21 см. Какова частота и энергия фотона такого излучения?
14. Сколько фотонов с длиной волн 6,5 10-7 м (красный свет) обладает суммарной энергией 1 Дж?
Сколько фотонов с длиной волн 4,00.10-7 м (синий свет) обладает суммарной энергией 1 Дж?
15. Пользуясь уравнением де Бройля, определите длину волны (в нм) каждого из перечисленных ниже движущихся объектов:
а) электрон, движущийся со скоростью, равной 90% скорости света;
б) молекула водорода, движущаяся со скоростью 1600 м/с;
в) винтовочная пуля массой 20 г, летящая со скоростью 1200 м/с;
г) локомотив массой 30000 кг, движущийся со скоростью 120 км/ч;
д) космический корабль массой 3000 кг, обладающий скоростью 3500 км/ч.
16. Вычислите длину волны де Бройля, которая соответствует частице с массой 6,6∙10-27 кг, движущейся со скоростью 70 м/с?
17. Энергия диссоциации HJ равна 298,4 кДж/моль. Можно ли разложить НJ на элементы при облучении ультрафиолетовым светом (λ =2∙10-7м)? Какую энергию надо затратить, чтобы разложить 5∙10-3г HJ?
18. Определите по правилу Клечковского последовательность заполнения электронами подуровней в атомах элементов, если их суммы (n+I) соответственно равны 6,7,8.
Каков порядковыйномер элемента, у которого:
а) заканчивается заполнение электронами орбитали 8s;
б) начинается заполнение электронами подуровня 5q?
19. Назовите элементы имеющие по одному электрону на подуровне: а) 3d; б ) 4d; в) 5d.
Написать электронные формулыатомов этих элементов и указать их положение в периодической системе – (период, группа и подгруппа).
20. Сколько свободных f-орбиталeй содержится в атомах лантаноидов от церия до самария включительно?
21. Напишите электронно-графические формулы атомов индия, германия и титана в нормальном и возбужденном состоянии.
22. Объясните, почему первый потенциал ионизации Мg больше, чем у натрия и алюминия?
23. Объясните общую закономерность изменения потенциалов ионизации у элементов одной группы периодической системы, учитывая размеры их атомов и эффективные заряды ядра.
24. Объясните, какой из ионов Со2+ или Со3+ имеет меньший радиус.
25. Объяснитепричины различия потенциалов ионизации у следующих пар элементов: а) Не и Li; б)Ве и Li;в) Be и В; г) N и O.
26. Объясните причины различия сродства к электрону для атомов следующих пар элементов: а) О и F;б) Cl и Вr; в) CI и F.
27. Какими правилами определяется порядок заполнения электронами оболочки атома? Приведите электронные конфигурации невозбужденных атомов Gе, Mn, Tiи ионов Ва2+, Со3+, Се4+.
28. Как изменяется значение первой энергии ионизации атомов элементов от их порядкового номера?
29. Сравните значения сродства к электрону атомов азота и кислорода. Какой из этих атомов имеет большее сродство к электрону и чем это объясняется?
30. Объясните характер изменения сродства к электрону у атомов галогенов; F(3,62), Cl(3,82, Br(3,54), J(3,24) эВ?
31. Расположите в порядке увеличения сродства к электрону атомы с конфигурациями ns1, ns2 , ns2p5.
32. Объясните, чем обусловлена немонотонность изменения ионизационных потенциалов по периоду.
33. Почему при монотонном увеличении заряда ядра и общего количества содержащихся в атоме электронов эффективный заряд атомов (Zэфф) изменяется немонотонно? Сравните
Н Не LiBe В С NО F Nе
Zэфф 1 1,345 1,26 1,66 1,56 1,82 2,07 2,00 2,28 2,52
Чем объясните уменьшение эффективного зарядаядра атома при
переходе от гелия к литию; от бериллия к бору; от азота к кислороду?
34. Какой из атомов с электронной конфигурацией 1)1s22s22р4; 2) 1s22s22p5;
3) 1s22s22p6; 4) 1s22s22p63s1; 5)1s22s22p63s2; 6) 1s22s22p63s23p1 имеет
наибольшее значение ионизационногопотенциала?
35. Объясните последовательность уменьшения экранирующего влияния электронов в ряду ns>np>nd>nf.
36. Сравните величины ионныхрадиусов и поясните причину различий в их значениях для следующих изоэлектронных ионов: 1,33(F-); 1,36(О2-); 0,98(Na+); 0,74(Mg2+); 0,5А(Al3+).
37. Чем объяснить, что в каждойиз групп периодической системы дляs- ир-элементов наблюдается скачок в изменении химических свойств при переходе от элементов II периода к элементам III периода и от элементов IV к элементам V периодa?
38. Почему разница в значениях первого и второго ионизационных потенциалов у атомов лития больше, чем у атомa бериллия?
39. Какие из перечисленных ниже обозначений атомных орбиталей не имеют смысла: 4f, 2d, 2s, 5p, 1p, 3f?
40. Сколько существует различных орбиталей,которые могут иметь указанные ниже обозначения: а) n=4; б) 4р; в) 2d; г) 3p?
41. Опишите форму орбитали и электронного облака, состояние которого характеризуется квантовыми числами: n=3, l=0,ml=0; n=3; l=1; ml=-1,0,+1; n=3; l=0; ml=0,±1,±2.
42. Одинакова ли энергия ионизации атома цезия и атома лития, у которого валентный электрон предварительно возбужден на 6s-подуровень? Ответ обосновать.
43. Написать электронно-графические формулы атомов йода в возбужденном состоянии, предшествующем образованию им соединений JCl3 J F5.
44. Сколько свободных d-орбиталей имеется ватомах титана и ванадия? Написать для них электронно-графическую структуру d-подуровня.
45. Назвать элементы 4,5,6 периодов, у которых заканчивается заполнение d-орбиталей (3d10, 4d10, 5d10). Написать электронные формулыатомов этих элементов и указать, к какому периоду, группе иподгруппе периодической системы они относятся.
46. Какие характеристики орбиталей определяются значением:
а) главного квантового числе n; б) орбитального (азимутального) квантового числа l; в) магнитного квантового числа ml?
47. Составьте электронные схемы следующих превращений:
а) Сr0 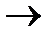 Cr3+; б)sn
Cr3+; б)sn  sn4+; в) Mn2+
sn4+; в) Mn2+  Мn4+.
Мn4+.
48. Приведите полную электронную конфигурацию атомов элементов со следующей конфигурацией их внешних слоев: 3s2; 6s1; 7s2;7р2. У какого из этих элементов и почемунаиболее выражены металлические свойства?
49. Назовите элементы, у атомов которых заканчивается заполнение
(n - 1)d- ns - и np- орбиталей.
50. Назовите элементы4-го периода, атомы которых содержат наибольшее число непарных d-электронов. Напишите электронно-графическую структуру их d -подуровня.
51. Энергетическое состояние внешнего электрона атома описывается следующими значениями квантовых чисел: n=3, l=0, ml=0. Атомы каких элементов имеют такой электрон? Составьте электронные формулы атомов этих элементов.
52. Сколько свободных d-oрбиталей содержится в атомах Sс, Ti, V? Напишите электронные формулы атомов этих элементов.
53. Пользуясь правилом Хунда, распределите электроны по орбиталям, отвечающим низшему энергетическомусостоянию атомов: марганца, азота, кислорода, кремния, кобальта.
54. Для атома с электроннойконфигурацией 1s22s22p3 впишите в таблицузначения четырех квантовых чисел: n, l, ml, ms, определяющие каждыйиз электронов в нормальном состоянии: номер электрона
...1, 2, 3, 4, 5, 6, 7
n
l
ml
ms
55. Атомы каких элементов имеют следующее строение наружного и предпоследнего электронного слоев:
a) 2s22p63s23p3; б) 3s23p63d34s2; в) 3s23p63dI04s24p5; г) 4s24p64d75s1;
д) 4s24p64d105s0?
56. Пользуясь правилoм Хунда, распределите электроны по орбиталям, отвечающим высшему энергетическому состоянию атомов:
фосфора, алюминия, серы, хрома.
57. Напишите электронные формулы элементов №110 и 113 и укажите, какое место они займут в периодической системе.
58. Напишите все квантовые числа для электронов атомов: а) лития, бериллия, бора, углерода: б) азота, кислорода, фтора, неона.
59. Объясните, почему сродство к электрону у Si и у Sбольше, чем у Р.
60. Объясните, почему вторая энергия ионизации магния больше его первой энергии ионизации, но не cтолъ велика, как вторая энергия ионизации натрия.
61. Какие ионы называются изоэлектронными? Чем объяснить уменьшение радиусов изоэлектронных ионов в ряду As3-,Se2-, Br-, Rb+, Sr2+, V3+?
62. Что представляет собой экранирование электронов в атоме.
63. Как изменяется с ростом порядкового номера значение первого потенциала ионизации у элементов третьего периода? Чем объяснить, что первый потенциал ионизации атомa Мg больше, чем
атомов Nа и Al?
64. Нейтральные атомы некоторых элементов имеют в основном состоянии следующие электронные конфигурации:
а)[Ne]3s23р2; б) [Ar]4s23d5; в) [Ar]4s13d10;
г) [Ar]4s23d104pI; д) [Ar]4s23d104s24p5; e) [Kr]5s24d1;
ж) [Kr]5s24d3; и) [Kr]5s24d5; к) [Kr]5s1;
л) [Kr]5s24d7; м) [Kr]5s04d10; н) [Хе] 6s1;
п) [Хе] 6s25d1; р) [Хе] 6s24f4; с) [Хе] 6s24f13;
т) [Хе] 6s26Р2; у) [Хе] 6s24fI45d2; ф) [Хе]6s24f145d5;
х) [Хе] 6s24fI45d8; ц) [Rn] 7s2.
Укажите на основании этих данных:
а) порядковый номер этого элемента;б) его атомный вес; в) число электронов в валентной оболочке; г) число неспаренных электронов в атоме этого элемента.
65. Экспериментально установлено, что молекула HF3 имеет треугольную форму, а комплексный ион [ВF4] - тетраэдрическое строение. Длина связи ВF в ВF3 короче (0,12 нм), чем в [BF4]- (0,143 нм). Объясните эти данные.
66. Объясните различие валентных углов для следующих пар молекул: OF2 (1030) и Н2О (104,50); NP3(1020) и NH3(1070);NF3(1030) и PF3(1040).
67. Каково пространственное расположение вокруг центрального атома молекулы двух, трех, четырех, пяти, шести электронных пар?
68. Определите стандартную теплоту образования из простых веществ в этилене, если энергия связей Н—Н, С—Н н С—С соответственно равна:
-435,9; -415,9 и -887,8 кДж/моль; теплота возгонки графита равна
+715,88 кДж/моль.
69. Вычислите энергию s-р ковлентной связи в молекуле HCl, если стандартная энтальпия образования НС1(г) равна 92,3 кДж/моль, а энергия связей Н—H и Cl — Cl соответственно равна (кДж/моль) 435,9 и -242,3.
70. Произведите приближенную оценку длины связей в молекулах NО и СО, если межъядерные расстояния в молекулах N2, O2 и C(графит) соответственно равны, м: 1,09∙ 10-10, 1,20∙ 10-10, 1,92∙10-10?
71. Расположите в порядке возрастания степени ионности связи В—Cl, Na—Cl, Ca—Cl, Be-Cl.
72. Рассчитайте разность относительных электроотрицательноcтей связей Na—О и Н—О в молекуле NaHCO3. Какая из связей наиболее приближается к ионной?
73. Определите, в каком из оксидов элементов третьего периода периодической системы Д.И.Менделеева связь Э—О наиболее приближается к ионной?
74. Определите полярность молекулы НВr, если длина диполя молекулы равна 0,18∙10-10м.
75. Длина диполя молекулы нитробензола C6H5NO2 равна 0,82·10-10м. Рассчитайте дипольный момент этой молекулы.
76. Объясните, почему уменьшается угол между связями в ряду соединений РF3 — PCl3 — PJ3, если угол Нal —Э—Hal в этих соединениях соответственно равен 104, 101, 980?
77. Сколько σ- и π-связей в молекулах С2H2 и CO2?
78. Объясните, почему в ряду элементов С, Si, Gе, Sn, Рb склонность к образованию гибридныхсвязей уменьшается от С к Рb.
79. Как объяснить разную длину связи N—N в различных молекулах азотсодержащих веществ;
N2 H3N N2(CH3)2 N2H4
l, A° 1,10 1,13 1,24 1,47?
80. Расположите приведенные соединения и ионы в ряд по мере увеличения степени ионности химической связи, используя значения эффективного заряда химически связанного центрального атома:
СuС12 СuВr2 ZnBr 2 Fe(CO)5 CrO 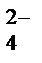 [Fe(CN)6]3-
[Fe(CN)6]3-
Zэфф +1,1 +1,0 +0,5 +0,4 +0,2 +1
81. Какая из следующих связей полярна? Укажите, для каждой полярной связи более электроотрицательный атом:
a) Cl—J; б) Р—Р; в) C—N; г) F—F; д) О—Н.
82. Изобразите геометрическую форму каждой из следующих молекулярных частиц: a) NOCl; б) C2H2; в) СН3CООН; г) SO2-4. Сколько связей имеет центральный атом? Покажите перекрывание орбиталей.
83. Укажите, к какому типу (ионному или ковалентному) принадлежат следующие вещества:
а) NН3;б) K2S; в) Br2;г) С12O;д) ВаС12; е) RеО.
84. Руководствуясь разностью относительных электроотрицательностей связи Э-О, определите, как меняется характер связи в оксидах элементов третьего периода периодической системы Д.И.Менделеева.
85. Вычислите разность относительных электроотрицательностей обеих связей в молекуле HОCI и определите, какая из них характеризуется большим процентом ионности.
86. Определите характер связи в молекулах SCI4, SiCl4, ClF3 и JBr и укажите для каждой направление смещения электронной плотности связи. Расположите молекулы в ряд в порядке увеличения полярности связи.
87. Установите пространственную структуру следующихмолекул и ионов, определив в каждом отдельном случае орбитали центрального атома и их тип гибридизации:
а) COS, COCl2 CF4,SiF62-;
б) hf3, NO¯2, ph3, po43-;
в) H2S, SCl2, SiF4, SO2F2;
г) Cl2O, ClO¯3, ClO¯4, JO65-.
88. Какова пространственная структура четырехатомных молекул типа АВ3? Объясните, в чем разница в структурах молекул BCl3 и AlBr3, РС13 и AICl3.
89. Чем объяснить, что температура плавления воды значительно выше температуры плавления фтороводорода (83°С), хотя дипольный момент молекулы Н2О (1,84 Д) меньше, чем молекулы HF (1,91Д)?
90. Почему элементы в высоких степенях окисления не образуют ионных соединений?
91. Почему энергия связи H-F выше, чем энергия связи F-F и Н-Н, и больше среднего арифметического из их значений? Почему разность между такой средней энергией и энергией связи H-Hal, определенной экспериментально,по ряду HF, Hj уменьшается?
92. Предскажите химическую формулу ионного соединения, образуемого каждой из следующих пар элементов: а)Sr, Br; б) Bе, O; в) Al,S; г) Zn,F; д)K,Se; e) Zn,O.
93. Какова геометрия следующих молекул и ионов? Сколько σ- и π-cвязей образует центральный атом?
а) SiH4; б) H2S; в) CO; г) N2; д) Н2O2; е) СS2.
94.Соединение SF6 обладает высокой устойчивостью и поэтому используется какэлектрондозирующий газ в высоковольтных трансформаторах. В отличие от него соединение SCl6 настолько неустойчиво, что его еще никому не удалось выделить. Объясните причину такого различия в устойчивости этих соединений.
95. Как и почему изменяется величина угла в вершинах пирамидальных молекул ЭН3 при переходе от РН3 к SbH3?
96. Длина диполя молекулы HF(I) равна 0,4 ∙10-10м. Вычислите её момент электрического диполя μ в кулон-метрах.
97. Какова пространственная структура молекул СО2 и CS2, моменты электрического диполя которых равны нулю?
98. Определите тип гибридизации орбиталей атома титана в тетраэдрической молекуле TiF4.
99. Определите тип гибридизации орбиталей электронов атомов фосфора при образовании им тетраэдрических молекул Р4 и иона РН 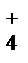 .
.
100. Какое место в периодической системе занимают элементы со свойствами типичных комплексообразователей? Чем это обусловлено?
101. Чем объяснить уменьшение дипольных моментов молекул в ряду галогеноводородов:
HF НСl НВr НJ
μ,Д 1,74 1,03 0,76 0,38?
102. Какие молекулы (H2Se, С2H2, F2O, CO2, O2, HСN, SnCl2) линейны, а какие - угловые?
103. Чем обусловлено сходство пространственной конфигурации молекул CO2, CS2, CSe2?
104. Какие из приведенных молекул и ионов имеют форму плоского треугольника: NН3, BH3, NO¯3, BrО 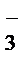 , СlО
, СlО 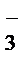 , SO
, SO 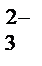 , CO
, CO  ?
?
105. Какова природа сил Ван-дер-Ваальса? Какой вид взаимодействия между частицами приводит к переходу в конденсированное состояние: Ne, N2, HJ, Cl2, NF3; H2O?
106. Чем объяснить разный характер изменения величин атомных радиусов в различных подгруппах периодической системы? Сравнить изменения атомных радиусов s-и d- элементов I группы, p- и d- элементов III группы, р-и d- элементов 1V группы.
107. Каким образом дипольный момент двухатомной молекулы позволяет оценить ионный, характер связи? Какова степень ионности связи в молекуле HF?
108. У какого из веществ сильнее выражен характер ионной связи: КJили ВаО? Чему равна степень ионности каждой из этих молекул в процентном выражении? (Данные о дипольных моментах указанных молекул следует найти в справочниках).
109. Вычислите дипольный момент или длину диполя молекулы КСl
l =1,66 ∙10-8м.
110. Радиостанция ведет передачи на частоте 1120 кГц. Какова длина волны и энергия фотона такого излучения?
7. 1. Варианты заданий
| Вариант | Номер задачи | ||||||
| I | а | 18б6 | 87г | ||||
| II | б | 87б | |||||
| III | в | 81г,д | 92г,д,е | ||||
| IV | г | 93г,д,е | |||||
| V | д | 83г,д,е | |||||
| VI | е | ||||||
| VII | ж | 2? | 93а,б,в | ||||
| VIII | з | ||||||
| IX | и | 29 г | 87в | ||||
| X | к | 58а | |||||
| XI | л | 55г,д | |||||
| XII | м | ||||||
| XIII | н | ||||||
| XIV | о | ||||||
| XV | 15а,б,в | п | 55а,б,в | ||||
| XVI | р | ||||||
| XVII | с | ||||||
| XVIII | 18а | т | 58б | 87а | |||
| XIX | J- \J | у | |||||
| XX | г.д. | ф |
ПРИЛОЖЕНИЕ 1
Периодическая система элементов Д.И.Менделеева
| 1. I | 2. II | 3. III | 4. IV | 5. V | 6. VI | 7. VII | 8. VIII | 9. | ||||
| Н* 1,00797 водород | 10. He 4,0026 Гелий | |||||||||||
| 11. Li 6,939 Литий | 12. Be 9,0122 Берилий | 13. В 10,811 Бор | 14. С 12,01115 Углерод | 15. N 14,0067Азот | 16. О 15,9994 Кислород | 17. F 18,9984 Фтор | 18. Ne 20,183 Неон | |||||
| 19. Na 22,9898 Натрий | 20. Mg 24,312 Магний | Al 26,9815 Алюминий | Si 28,086 Кремний | 21. Р 30,9738 Фосфор | 22. S 32,064 Сера | 23. Cl 35,453 Хлор | 24. Ar 39,948 Аргон | |||||
| 25. K 39,102 Калий | 26. Ca 40,08 Кальций | 27. Sc 44,956 Скандий | Ti 47,90 Титан | V 50,942 Ванадий | 28. Cr 51,996 Хром | 29. Mn 54,938 Марганец | Fe 55,847 Железо | 30. Co 58,9332 Кобальт | 31. Ni 58,71 Никель | |||
| 32. Cu 63,546 Медь | 33. Zn 65,37 Цинк | 34. Ga 69,72 Галий | 35. Ge 72,59 Германий | 36. As 74,9216 Мышьяк | 37. Se 78,96 Селен | 38. Br 79,904 Бром | 39. Kr 83,80 Криптон | |||||
| Rb 85,47 Рубидий | 40. Sr 87,62 Стронций | 41. Y 88,905 Иттрий | Zr 91,22 Цирконий | 42. Nb 92.906 Ниобий | 43. Mo 95,94 Молибден | Tc [99] Технеций | 44. Ru 101,07 Рутений | 45. Rh 102,905 Родий | 46. Pd 106,4 Паладий | |||
| Ag 107,868 Серебро | 47. Cd 112,40 Кадмий | 48. In 114,82 Индий | 49. Sn 118,69 Олово | 50. Sb 121,75 Сурьма | 51. Te 127,60 Теллур | 52. I 126,9044 Йод | 53. Xe 131,30 Ксенон | |||||
| 54. Cs 132,905 Цезий | 55. Ba 137,4 Барий | La* 138,81 Лантан | 56. Hf 178,49 Гафний | 57. Ta 180,948 Тантал | 58. W 183,85 Вольфрам | 59. Re 186,2 Рений | 60. Os 190,2 Осмий | 61. Ir 192,2 Иридий | 62. Pt 195,09 Платина | |||
| 63. Au 196,967 Золото | 64. Hg 200,59 Ртуть | 65. T1 204,37 Таллий | 66. Pb 207,19 Свинец | 67. Bi 208,980 Висмут | 68. Po [210] Полоний | 69. At Астат | 70. Rn [222] Радон | |||||
| 69. FR [223] Франций | 70. Ra [226] Радий | Ac** [227] Актиний | 71. Db [261] Дубний | 72. JI [262] Жолиотий | 73. Rr [263] Резерфный | 74. Bh [262] Борий | 75. Hn [265] Ганий | 76. Mt [266] Мейтнерий | ||||
*Лантаноиды
| 77. Ce 140,12 Церий | 78. Pr 140,907 Празеодин | 79. Nd 144,24 Неодим | 80. Pm [145] Прометий | 81. Sm 150,35 Самарий | 82. Eu 151,96 Европий | 83. Gd 157,25 Гадолиний | 84. Tb 158,924 Тербий | 85. Dy 162,50 Диспрозий | 86. Ho 164,930 Гольмий | 87. Er 167,26 Эрбий | 88. Tm 168,934 Тулий | 89. 70 90. Yb 173.04 Иттербий | 91. 71 92. Lu 174,97 Лютеций |
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 2362; Нарушение авторских прав?; Мы поможем в написании вашей работы!