
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Периодический закон Д.И. Менделеева в свете строения электронной оболочки атома
|
|
|
|
–3 –2 –1 0 +1 +2 +3
S
S 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
Существует два способа составления схем распределения электронов в атоме:
1. в виде формул электронных конфигураций, где верхний индекс указывает число электронов на данном подуровне
2. в виде квантовых ячеек (клетка, кружок или черточка) - для изображения электронной орбитали и стрелок - для обозначения электронов, направление которых указывает на ориентацию спинов электронов:


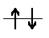
ПРИМЕР 2. Напишите электронную конфигурацию атома калия РЕШЕНИЕ:
19К – 1s2 2s2 2р6 3s2 3p6 4s1;
| n = 4 | ↑ | ||||||||||
| n = 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||||
| n = 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | d | ||||||
| n = 1 | ↑↓ | p |
Каждый электрон в атоме можно охарактеризовать с помощью набора квантовых чисел.
ПРИМЕР 3. О пишите состояние пятого электрона на 4f подуровне (4f5) в атоме с помощью набора квантовых чисел.
РЕШЕНИЕ
Электрон находится на 4f-подуровне, цифра 4 показывает значение главного квантового числа n = 4, а f-подуровню соответствует орбитальное квантовое число 3 (см. таблицу 1), т.е. l =3.  Магнитное квантовое число приобретает значения от –l до +l, т.е. в данном примере
Магнитное квантовое число приобретает значения от –l до +l, т.е. в данном примере

| 
| 
| 
| 
|
а пятый электрон попадает в магнитную квантовую ячейку с m=+1. Спиновое квантовое число S = —  .
.
Периодический закон был открыт в 1869 г. великим русским ученым Д.И. Менделеевым и сформулирован так:
свойства простых тел, а также свойства и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
До появления сведений о сложном строении атома основной характеристикой элемента служит атомный вес (относительная атомная масса). Развитие теории строения атома привело к установлению того факта, что главной характеристикой атома является положительный заряд его ядра. Поэтому в современной формулировке периодический закон гласит:
свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда ядер их атомов.
Заряд ядра (число протонов) равен атомному номеру элемента, определяет число электронов в атоме и, как следствие этого, строение его электронной оболочки в основном состоянии.
В зависимости от того, какой энергетический подуровень заполняется электроном последним, различают четыре типа элементов.
У элементов главных подгрупп заполняются s- и p- орбитали последнего слоя. Элементы, в которых заполняются s-орбитали последнего слоя, называются s-элементами. Максимальное число электронов s-орбитали – два.
р-элементы – это элементы, в которых заполняются р-орбитали последнего слоя. Максимальное число электронов p- орбитали – шесть.
d-элементы – это элементы, в которых заполняются d-орбитали. Максимальное число электронов d- орбиталей – десять.
f-элементы – это элементы, в которых заполняются f-орбитали третьего снаружи слоя. Максимальное число электронов f-орбиталей – четырнадцать.
Валентные электроны атома в невозбужденном состоянии находятся: у s-элементов на ns – подуровне
у р-элементов на ns и np – подуровне
у d-элементов на ns и (n-1)d – подуровне
у f-элементов на ns и (n-2)f – подуровне
Элементы со сходной электронной конфигурацией внешних энергетических уровней обладают и сходными химическими свойствами.
|
|
|
|
|
Дата добавления: 2015-05-26; Просмотров: 499; Нарушение авторских прав?; Мы поможем в написании вашей работы!