
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизмы компенсации острой дыхательной недостаточности
|
|
|
|
Классификация и патогенез острой дыхательной недостаточности
Дыхательная недостаточность — состояние организма, при котором либо не обеспечивается поддержание нормального напряжения Оз и СОа в артериальной крови, либо оно достигается за счет повышенной работы внешнего дыхания, приводящей к снижению функциональных возможностей организма, либо поддерживается искусственным путем1.
Определение понятия
ДЫХАТЕЛЬНОЙ НЕДОСТАТОЧНОСТИ
ОБЩИЕ ПРЕДСТАВЛЕНИЯ ОБ ОСТРОЙ
ОБЩИЕ ВОПРОСЫ РЕСПИРАТОРНОЙ ПОДДЕРЖКИ
В этом разделе мы касаемся вопросов, имеющих значение для всей проблемы респираторной поддержки как в анестезиологии, так и в интенсивной терапии. В нем помещены главы, посвященные патофизиологии искусственной и вспомогательной вентиляции лёгких и способов присоединения респиратора к дыхательным путям больного. По традиции этот раздел должен был бы начаться с краткого описания основ физиологии внешнего дыхания, однако эти вопросы в достаточной мере отражены в многочисленных руководствах и монографиях и мы вряд ли можем что-либо добавить. Поэтому мы сочли правильным начать изложение с общих представлений об острой дыхательной недостаточности, хотя эти данные относятся в первую очередь к интенсивной терапии и в меньшей к анестезиологии. Однако оперативное вмешательство и анестезия сами по себе могут явиться причиной развития острых нарушений дыхания; кроме того, считаем, что понимание особенностей воздействия методов респираторной поддержки на организм невозможно без четкого представления о том, что такое дыхательная недостаточность.
Г л а в а 1
Имеется множество определений дыхательной недостаточности. Не вдаваясь в анализ и критический обзор разноречивых взглядов многих исследователей, приведем определение, основанное на принятом в 1962 г. на XV Всесоюзном съезде терапевтов, с небольшим, но практически важным дополнением. Это определение отражает взгляды классиков отечественной физиологии и терапии Л.Л.Шика и А.Г.Дембо. На наш взгляд, оно лучше всего подходит для клинической практики.
Как видно из этого определения, дыхательная недостаточность совсем не обязательно проявляется гипоксемией и ги-перкапнией, при медленном развитии включается ряд компенсаторных механизмов (в первую очередь усиленная работа дыхания), позволяющих длительно поддерживать РаСО2 и РаС(>2 на приемлемом для организма уровне. На ранних стадиях медленно развивающегося процесса нарушения газового состава и кислотно-основного состояния (КОС) крови могут возникать только при физической нагрузке. Дыхательная недостаточность бывает острой и хронической. Последняя нарастает постепенно, развивается в течение многих месяцев или лет. Для нее характерно сочетание гипоксемии с гиперкап-нией, но рН может длительно оставаться в пределах нормальных значений. Расстройства гемодинамики также возникают достаточно поздно, а поражение недыхательных функций лёгких — в основном в финальной стадии и при декомпенсации. Острая дыхательная недостаточность (ОДН) имеет важные качественные отличия от хронической.
Острая дыхательная недостаточность — быстро нарастающее тяжелое состояние, обусловленное несоответствием возможностей аппарата внешнего дыхания метаболическим потребностям органов и тканей, при котором наступает максимальное напряжение компенсаторных механизмов дыхания и кровообращения с последующим их истощением. Даже при максимальном напряжении компенсаторных механизмов не обеспечивается нормальное РаСО2 и нормальное РаС(>2. ОДН всегда сопровождается нарушениями гемодинамики.
Для ОДН характерно быстрое развитие, уже через несколько часов, а иногда и минут может наступить смерть больного.
1 Нарушение оксигенации артериальной крови может быть вызвано другими причинами (низкое Ff>^, внутрисердечный шунт при врожденных пороках сердца и др.), но, строго говоря, это не относится к дыхательной недостаточности.
Характерным признаком ОДН является гипоксемия (если она не устранена искусственным путем). При большинстве форм ОДН гипоксемия чаще всего сочетается с гипокапнией, повышение РаСО2 происходит в далеко зашедших стадиях, а также при некоторых формах ОДН, о чем будет сказано ниже. На раннем этапе возникают сдвиг рН в кислую сторону за счет генерализованных нарушений гемодинамики и нарушение метаболических функций лёгких.
В литературе предложено множество классификаций ОДН. В практической работе можно использовать предложенное Ю.Н.Шаниным и А.Л.Костюченко (1975) деление ОДН на вентиляционную, когда нарушена механика дыхания, и паренхиматозную, которая обусловлена патологическими процессами в лёгких. Также целесообразно различать первичную ОДН, связанную с повреждением органов и систем, входящих в анатомо-физиологический комплекс внешнего дыхания, и вторичную, которая возникает в результате развития патологических процессов в системах, не относящихся непосредственно к органам дыхания, но сопровождающихся резким повышением потребления кислорода, которбе по тем или иным причинам не может быть обеспечено системой дыхания [Кассиль В.Л., Рябова Н.М., 1977]. Вторичная ОДН всегда сопровождается недостаточностью кровообращения или возникает на её фоне. Этиологическую и патогенетическую сущность дыхательной недостаточности наиболее полно, на наш взгляд, отражает классификация Б.Е.Вотчала (1973). Она была предложена для хронической дыхательной недостаточности, но, с некоторыми дополнениями, хорошо отражает также этиологию и патогенез ОДН.
A. Центрогенная дыхательная недостаточность.
Б. Нервно-мышечная дыхательная недостаточность.
B. Париетальная или торакодиафрагмальная дыхательная недостаточность.
Г. Бронхолегочная дыхательная недостаточность.
1) обструктивная;.. - >,
2) рестриктивная (ограничительная);
3) диффузионная.
Особой формой является дыхательная недостаточность, вызванная первичным поражением легочного кровообращения.
А. Центрогенная ОДН. Возникает при травмах и заболеваниях головного мозга, сдавлении и дислокации его ствола, в
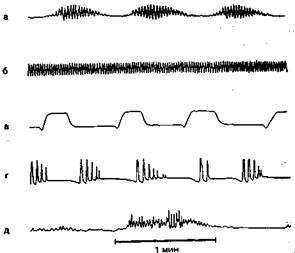
Рис. 1.1. Некоторые типы нарушений дыхания. '"
а — дыхание Чейна—Стокса; б — центральная нейрогенная гипервентиляция; в/--апнейстическое дыхание; г — групповое периодическое дыхание; д -* «Тгис+ичвсков дыхание [Плам Ф., Познер Дж.Б., 1986].: i,.• ',,у, •
раннем периоде после клинической смерти, при некоторых интоксикациях (опиаты, барбитураты и др.), нарушениях афферентной импульсации. Как известно, регуляция дыхания осуществляется сложной и политопной системой. В нее входят хеморецепторы продолговатого мозга, реагирующие на СО2 и Н-ионы; хеморецепторы каротидных и аортальных рефлексогенных зон, реагирующие на уровень оксигенации артериальной крови; ирритантные, юкстакапиллярные и термочувствительные рецепторы лёгких и дыхательных путей; рецепторы растяжения в лёгких и грудной клетке; опиатные рецепторы мостомедуллярной зоны, которые реагируют на концентрацию эндорфинов (опиоидные пептиды); определенные зоны коры головного мозга; ретикулярная формация; передние рога спинного мозга и др. [Шик Л.Л., 1994]. Весь этот комплекс определяет основные паттерны дыхания (частоту, глубину, длительность фаз вдоха и выдоха, ритмичность, распределение скорости потока внутри фаз и т.д.) и обеспечивает соответствие легочной вентиляции метаболическим потребностям организма [Бреслав И.С., 1994]. Достаточно нарушения хотя бы одного из механизмов регуляции дыхания, чтобы изменить весь процесс легочной вентиляции.
Наиболее яркий клинический симптом центрогенной ОДН — нарушение ритма дыхания или появление патологи-
ческих ритмов. К последним относятся дыхание Чейна—Стокса, характерное для поражения переднего мозга; центральная нейрогенная гипервентиляция (повреждение гипоталамуса); апнейстическое и групповое периодическое дыхание (повреждение нижних отделов покрышки мозга); дыхание Биота, или атактическое дыхание (поражение верхних отделов ствола); дыхание агонального типа (гаспинг), возникающее при повреждении продолговатого мозга и в агональном периоде. Одной из форм центрогенных нарушений дыхания является потеря дыхательного автоматизма с сохраненным произвольным контролем (синдром,«проклятия Ундины») [Плам Ф., Познер Дж.Б., 1986; Попова Л.М., 1993; Зильбер А.П., 1994]. При так называемом синдроме деэфферентации (locked-in), возникающем при обширных инфарктах ствола мозга, поли-нейропатиях, боковом амиотрофическом склерозе, описана полная утрата произвольной регуляции дыхания при сохранении дыхательного автоматизма и реакции на избыток СОз [Попова Л.М. и др., 1983]. Часть из этих нарушений представлена на рис. 1.1.
Следует подчеркнуть, что, с одной стороны, расстройства центральной регуляции дыхания в клинической практике никогда не бывают изолированными, к ним, как правило, присоединяются нарушения проходимости дыхательных путей, вентиляционно-перфузионных отношений в лёгких и др. С другой стороны, практически все формы ОДН, особенно в далеко зашедших стадиях, сопровождаются нарушениями центрального управления дыханием, при этом совсем не обязательно, чтобы больной был в коматозном состоянии. К сожалению, в практической работе эти нарушения не всегда распознаются и им часто не уделяется достаточного внимания.
Б. Нервно-мышечная ОДН. Развивается при расстройствах передачи нервного импульса дыхательным мышцам и нарушении их функций. Она возникает при травмах и заболеваниях спинного мозга с поражением передних рогов его шейного и грудного отделов, некоторых экзогенных интоксикациях (отравлениях курареподобными веществами, мускаринами, фос-форорганическими соединениями, при остаточном действии миорелаксантов после общей анестезии и др.), а также при нарушениях сократимости дыхательных мышц: при судорожном синдроме любого происхождения, миастении, синдроме Гийе-на—Барре и т.д. Кроме того, нервно-мышечная ОДН может развиться при тяжелых водно-электролитных нарушениях, особенно при выраженной гипокалиемии.
При нервно-мышечной ОДН всегда нарушается функция дыхательных мышц, в результате чего в той или иной мере нарушается их способность выполнять работу по обеспечению дыхания. Напомним, что эти мышцы делятся на мышцы вдоха,
основные (диафрагма, наружные межреберные мышцы) и вспомогательные (лестничные мышцы и мышцы шеи) и мышцы выдоха (мышцы передней брюшной стенки, внутренние межреберные) [Исаев Г.Г., 1994]. Хотя они составляют всего 7 % массы тела, но при спокойном дыхании потребляют от 20 до 50 мл кислорода в 1 мин (10—20 % УОз), а при большой физической нагрузке и патологических состояниях до 1000— 1500 мл О2 в 1 мин [Зильбер А.П., 1984; Рябов Г.А., 1994, и др.]. Работа дыхания в спокойном состоянии составляет 0,2— 0,35 кгм/мин, причем на преодоление эластического сопротивления затрачивается 70 % работы, а неэластического — 30 %.
Характерная черта этой формы ОДН — раннее развитие ги-повентиляции и гиперкапнии, хотя в начальном периоде в зависимости от этиологии может наблюдаться увеличение минутного объема дыхания (МОД) за счет выраженного тахип-ноэ при уменьшенном дыхательном объеме (Ут). Гиперкапния, сопровождаясь увеличением РдСОз, приводит к снижению РдО2 вследствие изменения состава альвеолярного газа. Рано также возникают явления бронхиальной обструкции в связи с нарушением процесса откашливания (см. ниже). Кроме того, гиповентиляция ведет к снижению активности сурфактанта, развитию микроателектазов [Шик Л.Л., Канаев Н.Н., 1980; Weiss J. et al., 1987, и др.].
В. Париетальная, или торакодиафрагмалъная, ОДН. Развивается при болевом синдроме, связанном с дыхательными движениями (травма, ранний период после операций на органах грудной клетки и верхнего этажа брюшной полости), нарушении каркасности грудной клетки (множественный «окончатый» перелом ребер по нескольким линиям, обширная торакопластика), сдавлении лёгкого массивным пневмо-, гемо- или гидротораксом, нарушении функции диафрагмы. Во всех этих случаях значительно уменьшается vt и компенсация до определенного предела осуществляется за счет учащения дыхания. Так же, как и при нервно-мышечной ОДН, происходит расстройство кашлевого механизма, декомпенсация быстро приводит к альвеолярной гиповентиляции и развитию гиперкапнии. Кроме того, гиповентиляция лёгкого или его долей обусловливает быстрое развитие ателектазов и воспалительных процессов (см. ниже).
Г. Бронхолегочная ОДН. С этой формой дыхательной недостаточности анестезиологу и реаниматологу приходится иметь дело, пожалуй, чаще всего. Отметим, что при всех остальных формах ОДН нарушения функций лёгких и дыхательных путей обязательно присутствуют и играют весьма важную роль, особенно в далеко зашедших стадиях. В конечном счете патогенетические механизмы, приводящие к гипок-семии (а затем и к гиперкапнии), при бронхолегочной ОДН

Рис. 1.2. Схема вентиляционно-перфузионных отношений в лёгких в норме (а) и при патологии (6).
заключаются в первую очередь в нарушении вентиляционно-перфузионных отношений. Как известно, в норме перфузия кровью происходит в тех участках лёгких, которые в это время вентилируются (рефлекс фон Эйлера). Именно в этих участках и осуществляется газообмен между альвеолярным воздухом и кровью легочных капилляров. У здорового человека вентиляционно-перфузионное отношение (va/qt) равно 0,8—0,83. Не вентилируемые в данный момент участки лёгких находятся в состоянии «физиологического ателектаза», перфузии в них нет. Если эти участки начинают вентилироваться (например, при физической нагрузке), легочный кровоток перераспределяется и перфузия захватывает и эти зоны. При ряде патологических процессов это соответствие нарушается и тогда в лёгких возникают три зоны (рис. 1.2). В первой, где имеются и вентиляция, и перфузия, происходит газообмен. Во второй (пунктирная штриховка) альвеолы вентилируются, но нет перфузии, а следовательно, и газообмена. Эта зона входит в объем физиологического мертвого пространства (Vrj) и значительно увеличивает его. Для вентиляции важна не столько сама величина vd, сколько отношение объема мертвого пространства к дыхательному объему (V-г). В норме отношение vd/vt не превышает 0,3, т.е. 70 % вдыхаемого за один вдох воздуха участвует в газообмене и 30 % остается в мертвом пространстве. Увеличение vd/vt означает, что организм в большей мере расходует энергию на вентиляцию мертвого пространства и в меньшей — на альвеолярную вентиляцию. В качестве компенсаторной реакции происходит увеличение МОД сначала за счет повышения vt (если это возможно), а затем за счет увеличения частоты дыхания. При этом возрастают энергетические затраты на дыхание.
Еще большую опасность представляет третья зона (сплошная вертикальная штриховка), где есть кровоток, но нет вентиляции и соответственно газообмена. Притекающая в эту зону венозная кровь оттекает из нее неартериализованной. Смешиваясь с кровью, оттекающей от вентилируемых участков, она создает венозное примешивание к артериальной крови, т.е. увеличивает шунт справа налево. В норме этот шунт не превышает 7 % от объема кровотока. При увеличении шунта развивается гипоксемия, которую организм не может компенсировать повышением работы дыхания. В начальных стадиях ОДН, как уже упоминалось, гипоксемия сочетается с гипокапнией за счет усиленной вентиляции тех участков лёгких, где происходит газообмен. Однако гипервентиляция, способствуя усиленной элиминации СОз, не может насытить гемоглобин кислородом более чем до 100 % и та часть крови, в которой SaC>2 осталось низким, примешиваясь к полностью артериализованной, создает венозное примешивание.
Увеличение вено-артериального шунта в лёгких приводит к повышению альвеолярно-артериальной разницы по кислороду [D(A—a)C>2]. У здорового человека при дыхании воздухом она не должна превышать 20 мм рт.ст., а при дыхании 100 % кислородом — 100 мм рт.ст. Возрастание D(A—а)СО2 ведет к снижению РаСО2, увеличить которое можно, только повысив РдСО2 -Однако при значительном увеличении D(A—a)O2, например до 450 мм рт.ст. и более, даже дыхание 100 % кислородом (FjO2 = 1,0) не устраняет гипоксемии.
Различают обструктивную и рестриктивную бронхолегоч-ную ОДН. «В чистом виде» они развиваются достаточно редко, как правило, мы имеем дело со смешанными формами, при которых может превалировать тот или другой процесс.
1) Обструктивная ОДН. Возникает при нарушениях проходимости дыхательных путей: верхних (западение языка, попадание инородного тела в гортань или трахею, отек гортани, выраженный ларингоспазм, гематома, опухоль, странгуляция и др.) и нижних, т.е. бронхов (бронхоспазм, бронхорея, нарушения откашливания, преждевременное закрытие дыхательных путей и др.).
Необходимо, хотя бы вкратце, остановиться на патогенезе нарушений эвакуации бронхиального секрета, продуцируемого бронхиальными железами в норме от 10 до 50 мл в сутки [Федосеев Г.Б., 1994]. Его продвижение от мелких к крупным бронхам происходит под воздействием биений ворсинок реснитчатого эпителия, выстилающего стенки бронхов. Ворсинки совершают до 1000 движений в минуту [Зильбер А.П., 1984]. Каждая ворсинка представляет собой волосок со структурой, похожей на коготь на конце, который захватывает вязкий секрет. Большая часть ворсинки находится в слое секрета с низкой
• вязкостью, но «коготь» проникает в область высокой вязкости. ИВорсинки движутся регулярно и синхронно и продвигают сек-•Ьет со скоростью 0,3—1,0 мм/мин в мелких бронхах и 10— КО мм/мин в трахее [Conway J.H., Holgate S.T., 1991]. ^Эффективность продвижения секрета в трахею зависит от вязкости секрета, т.е. от его гидратации. Из трахеи и крупных бронхов секрет удаляется при помощи механизма откашливания. Откашливание состоит из 5 последовательных фаз: 1) каш-левое раздражение (не наступает, если больной в коме); 2) глубокий вдох (не наступает, если больной не может его сделать); 3) смыкание голосовой щели (нет, если больной интуби-рован или сделана трах'еостомия); 4) экспираторное напряжение при закрытой голосовой щели (невозможно, если поражены мышцы выдоха или при парезе кишечника); 5) раскрытие голосовой щели и изгнание воздуха со скоростью 5—6 л/с. (не произойдет, если не было хотя бы одной из предшествующих фаз). Из приведенных данных видно, что кашель не только сложный акт, эффективность которого резко снижается под воздействием многих факторов. Кроме того, процесс эвакуации бронхиального секрета нарушается вследствие изменений реологических свойств самого секрета в результате гипогидрата-ции организма или поступления в дыхательные пути сухого и несогретого воздуха. В этом случае он становится слишком вязким, а кроме того, резко нарушается функция ворсинок реснитчатого эпителия, они перестают двигаться или движутся несинхронно. Эти явления значительно усиливаются при воспалительных процессах в бронхах. Тогда секрет начинает накапливаться в дыхательных путях, нарушая их проходимость. Но нарушение проходимости дыхательных путей происходит не только вследствие задержки в них секрета. Другой важной причиной является преждевременное экспираторное закрытие дыхательных путей (ЭЗДП).
ЭЗДП — физиологический феномен, наступающий в конце нормального выдоха. Спадение мелких бронхов происходит по трем причинам:
1 — в конце выдоха выравнивается давление между бронхами и
плевральной полостью, когда давление в плевральной полости превышает давление в бронхах, они закрываются;
2 — движущийся поток оказывает на стенки бронхов меньшее
давление, чем неподвижный воздух в окружающих альвеолах (закон Бернулли);
3 — во время выдоха лёгкие уменьшаются в размере,
соответственно уменьшается диаметр мелких бронхов, они спадаются под действием поверхностного натяжения.
Каждый анестезиолог, использовавший для ручной вентиляции не мешок, а мех аппарата, знает, что если при выдохе

Рис. 1.3. Давление в дыхательных путях. Объяснение в тексте.
сильно потянуть за мех, выдох прерывается (симптом «воздушной ловушки»). Причина этого явления — преждевременное ЭЗДП в результате создания в них отрицательного давления. Если после этого мех отпустить, он сам поднимается — выдох продолжается, дыхательные пути снова раскрываются.
Преждевременному ЭЗДП способствуют поражение опорных структур мелких бронхов и сдавление их расширенными перибронхиальными артериями, снижение тонуса стенок крупных бронхов, снижение активности сурфактанта и увеличение силы поверхностного натяжения в бронхиолах и мелких бронхах, форсированное дыхание с усиленным выдохом, переполнение кровью малого круга кровообращения. В наиболее тяжелых случаях экспираторный коллапс может происходить в главных бронхах и даже в трахее. При бронхоскопии хорошо видно, как во время выдоха мембранозная часть трахеи и слизистая оболочка крупных бронхов пролабируют в их просвет.
Преждевременное ЭЗДП приводит к усилению рестриктив-ных процессов (см. ниже), снижению функциональной остаточной емкости (ФОБ) лёгких, гипоксемии и требует значительного увеличения давления в дыхательных путях для расправления бронхов [Николаенко Э.М., 1989].
В различных участках бронхиального дерева обструктивные процессы развиваются по-разному. Это приводит к усилению регионарной неравномерности вентиляции лёгких и увеличению шунтирования крови справа налево. Нарушение проходимости верхних дыхательных путей может возникнуть быстро, например при их обтурации инородным телом. Если не принять энергичные меры, то наступит смерть от асфиксии. Но чаще обструкция бронхов развивается постепенно. При этом вначале газовый состав крови существенно не меняется, поскольку усиливается работа дыхания. Однако нарастающее бронхиальное сопротивление увеличивает энергетическую цену дыхания и приводит к истощению компенсаторных механизмов. Возника-
ет гипоксемия, к которой затем присоединяется гиперкапния. Нарушение бронхиальной проходимости проявляется повышением аэродинамического сопротивления (R — resistance). Сопротивление дыхательных путей характеризуется частным от деления резистивного давления (рис. 1.3), образованного движением потока газа (если нет потока, то нет и резистивного сопротивления) на скорость потока:
R = Pres/V [см вод.ст./л х с"1]. = ; :
-\f, -,,.,,\
У здорового человека R не превышает 4—5 см вод.ст./л х с"1. В современных респираторах величина R обычно отражается на экране дисплея или специальном цифровом индикаторе.
2) Рестриктивная ОДН. Строго говоря, термин «рестрикция» больше относится к хронической дыхательной недостаточности. Однако, на наш взгляд, он хорошо отражает и процессы, которые происходят в легочной паренхиме при ОДН. Рестриктивная ОДН возникает при травме и заболеваниях лёгких, после обширных резекций и т.д. и сопровождается снижением эластичности лёгких, следовательно, каждый вдох требует значительного повышения работы дыхания. Причинами развития этой формы ОДН могут быть пневмонии, обширные ателектазы, нагноительные заболевания, гематомы, пнев-мониты. Своеобразным процессом, вызывающим тяжелую ОДН, является респираторный дистресс-синдром, называемый также «шоковым лёгким».
Одним из основных механизмов рестрикции при ОДН является снижение продукции и активности сурфактанта, что сопровождается увеличением сил поверхностного натяжения не только в альвеолах, но также в бронхиолах и мелких бронхах. В результате альвеолы стремятся к спадению, возникают множественные необтурационные ателектазы, которые крайне трудно поддаются расправлению.
Другим важнейшим механизмом уменьшения эластичности лёгких является накопление воды в интерстиции [Николаенко Э.М., 1989; Peters R.M., 1984], повреждение его белков (в первую очередь эластина и фибронектина). Интерстициаль-ный отек может развиваться в результате повышения давления в малом круге кровообращения, увеличения проницаемости альвеолярно-капиллярной мембраны, резкого снижения онкотического давления плазмы. Особенно увеличивается накопление воды в интерстиции лёгких при гиперкапнии [Кочетков С.Г. и др., 1994], а также у больных со сниженными резервами кардиореспираторной системы [Neki H., 1990].
Проявление уменьшения эластичности лёгких — снижение их растяжимости (С — compliance). Количественно растяжимость характеризуется частным от деления дыхательного объ-
ема на вызванное его введением изменение внутрилегочного давления или на эластическое давление (давление в дыхательных путях в отсутствие потока, например во время инспира-торной паузы, см. главу 4).
С = VT/Pel [мл/см вод.ст.].
У здорового человека С равна 150—250 мл/см вод.ст. В современных респираторах величина растяжимости обычно отражается на экране дисплея или специальном цифровом
индикаторе.
Снижение растяжимости лёгких всегда сопровождается ги-
поксемией [Bartlett R., 1980, и др.].
3) Диффузионная ОДН. Напомним, что в норме диффузия газов происходит через альвеолярно-капиллярную мембрану, толщина которой вместе с пристеночным слоем плазмы составляет 0,7—0,9 мкм, со скоростью 25 (мл/мин) х мм рт.ст."1. Считается, что ОДН, связанная с нарушением диффузии кислорода через альвеолярно-капиллярную мембрану (углекислота гораздо легче диффундирует через жидкость), возникает при альвеолярном отеке лёгких, респираторном дистресс-синдроме (см. ниже), лимфостазе. Более спорна роль нарушений диффузии при интерстициальном отеке. Утолщение альвеолярно-ка-пиллярной мембраны происходит за счет накопления воды пневмоцитами второго порядка, которые обеспечивают метаболические функции лёгких (например, продукцию сурфактан-та), но не участвуют в газообмене, т.е. не влияют на процесс диффузии. Этот процесс происходит через пневмоциты первого порядка, но они не способны накапливать воду [Николаен-ко Э.М., 1989], поэтому гипоксия, которую при интерстициальном отеке лёгких некоторые связывают с диффузионными нарушениями, скорее всего на самом деле является результатом увеличенного шунта справа налево.
Поражение легочного кровообращения. Первичное нарушение легочного кровообращения может возникать при тромбоэмболии ветвей легочной артерии, жировой эмболии, эмболии околоплодными водами, сепсисе, гипоксической гипоксии (вследствие гипоксической вазоконстрикции), анафилактическом шоке и «шоковом легком» (см. ниже). К выраженной легочной гипертензии, в результате которой развивается альвеолярный отек лёгких, приводит также острая левоже-лудочковая недостаточность.
При рассыпной тромбоэмболии достаточно крупных ветвей легочной артерии, наряду с выраженной гипоксемией, быстро возникает гиперкапния, по-видимому, в результате резкого увеличения отношения Vrj/Vx-
Респираторный дистресс-синдром взрослых. В последние годы все больше внимания уделяется своеобразной форме
ОДН, которая получила название «респираторный дистресс-синдром взрослых» (РДСВ — adult respiratory distress syn-drom — ARDS), или «шоковое легкое».
Сегодня мы понимаем под РДСВ тяжелые неспецифические изменения в лёгких, возникающие после перенесенного стресса. Пусковыми механизмами РДСВ являются грубые нарушения микроциркуляции, гипоксия и некроз тканей, активация медиаторов. РДСВ может возникать в результате любого тяжелого стресса: множественной травмы, кровопотери, кардио-генного или ожогового шока, сепсиса, инфекционного заболевания, экзогенной интоксикации и др. Кроме того, причиной РДСВ могут служить переливание больших доз консервированной крови, особенно длительных сроков хранения, недостаточно квалифицированное проведение ИВЛ и другие факторы. Как правило, «шоковое легкое» сочетается с поражением других органов и систем (синдром полиорганной недостаточности).
Нарушения гемодинамики при шоке, который не без основания называют «кризисом микроциркуляции», возникают в первую очередь как компенсаторная реакция на уменьшение объема циркулирующей крови. Сначала наступает генерализованный спазм периферических сосудов: артериол, метарте-риол, прекапиллярных сфинктеров. Этот спазм возникает в системе микроциркуляции паренхиматозных органов, кишечника, мышц, кожи, но вначале не затрагивает мозгового и коронарного кровотока (централизация кровообращения). Поэтому больные, несмотря на низкое артериальное давление, длительно сохраняют сознание и сердечный индекс у них может быть даже повышенным, если первопричиной гемоди-намических расстройств не служит инфаркт миокарда. В периферических же сосудах вслед за спазмом наступает стаз крови в капиллярах и метартериолах, кровоток начинает осуществляться через артериоло-венулярные шунты, которые в норме не функционируют. При дальнейшем нарастании шока и переходе спазма микрососудов в парез кровоток в отдельных, все расширяющихся областях может вообще прекратиться. Стаз крови приводит к экстравазации плазмы в окружающие ткани и сгущению крови. Форменные элементы крови в результате местной гипоксии, ацидоза и нарушения нормального поверхностного заряда начинают деформироваться и слипаться друг с другом, образуя агрегаты, называемые «сладжами» от английского sludge (тина, отстой). Эти агрегаты не являются тромбами, в них нет фибрина, но они, будучи выброшенными при восстановлении кровотока в венозную систему, попадают в малый круг кровообращения, вызывая эмболию микрососудов лёгких. Слипание форменных элементов крови между собой и с интимой сосудов — проявле-
ние синдрома диссеминированного внутрисосудистого свертывания крови (ДВС). /
Одновременно с началом развития синдрома ДВС начинается выраженная реакция организма на гигажсические и некротические изменения в тканях, а также на проникновение в кровь бактерий и токсинов бактериальных оболочек (липопо-лисахаридов). Некоторые авторы вообще считают, что в основе РДВС лежит общая неспецифическая воспалительная реакция на воздействие различных патогенных факторов [Гологор-ский В.А. и др., 1992, и др.]. Возникает генерализованный фагоцитоз, происходит активация лейкоцитов и целой цепи медиаторов, что описывается рядом авторов, как «биохимическая буря».
В первую очередь следует упомянуть об активации цитоки-нов, к которым относятся интерлейкины-1, -6 и -8, которые выделяются макрофагами и эндотелиальными клетками, лей-котрины и кахектин (TNF). Активируется брадикинин. Эти медиаторы способствуют агрегации и распаду лейкоцитов (особенно лейкотрин В-4 и кахектин) и прилипанию их к эндотелию. Распад лейкоцитов сопровождается выделением свободных кислородных радикалов и протеаз, что приводит к гибели эндотелия и усиливает выделение интерлейкинов [Ste-phenson A.H. et al., 1988; Roten R. et al., 1991; Suter P.M. et al., 1992, и др.]. Наступает активация простагландина тром-боксана А-2, способствующего вазоконстрикции и поддерживающего её, в то же время содержание в крови простациклина (антагониста тромбоксана) снижается. Выраженная активация реакции комплементов сопровождается повышением проницаемости сосудистых стенок и выделением гистамина [Золотокрылина Е.С., 1996; Marin R.R. et al., 1991]. Снижается содержание белка с опсониновой активностью фибронекти-на, «биологического клея», обеспечивающего прикрепление эндотелиальных и альвеолярных клеток к базальной мембране, еще больше возрастает проницаемость сосудистой стенки. Под действием биологически активных веществ повышается посткапиллярное сопротивление в малом круге кровообращения, повышается давление в легочной артерии, резко увеличивается кровенаполнение лёгких, значительно возрастает отношение vd/vt, уменьшается растяжимость лёгких [Золотокрылина Е.С., 1977; Гиммельфарб Г.Н. и др., 1985; Василенко Н.И., Эделева Н.В., 1990; Кирсанова А.А. и др., 1992].
Все эти реакции, а также ряд других не только реализуют синдром ДВС и приводят к углублению расстройств периферического кровообращения, но и вызывают гиперметаболизм. Резко увеличиваются метаболические потребности организма, в частности в кислороде. Потребление кислорода респираторной системой достигает 40 % от общего VC>2 [Hoffman В. et al., 1991].
Как правило, РДСВ, или «шоковое легкое», начинает развиваться в конце 1-х — начале 2-х суток после выведения больного из состояния шока. В основе этого синдрома лежит уже упоминавшаяся множественная эмболия микрососудов малого круга кровообращения агрегатами [Багдатьев В.Е. и др., 1990, и др.]. В результате происходит увеличение кровенаполнения лёгких более чем в 5 раз, возникает легочная ги-пертензия. Для «шокового лёгкого» характерно поражение в первую очередь интерстиция, обеднение его белками эластином и фибронектином, накопление в нем воды и белков плазмы за счет повышения, проницаемости мембран. Вообще при РДСВ очень рано нарушаются недыхательные функции лёгких, в частности снижаются продукция и активность сурфак-тантов, а следовательно, уменьшается растяжимость лёгких, нарушаются реологические свойства бронхиального секрета [Козлов И.А. и др., 1983; Авруцкий М.Я. и др., 1987; Муста-фин А.Х. и др., 1990] и фибринолитическая функция лёгких [Багдатьев В.Е. и др., 1991].
В лёгких нарушаются регионарные вентиляционно-перфу-зионные отношения, увеличивается отношение vd/vt, возрастает шунтирование крови, наступает преждевременное экспираторное закрытие дыхательных путей. Возникают множественные ателектазы, кровоизлияния, деформация альвеол, из которых исчезает сурфактант [Карнаухов Н.Ф., Дерижано-ваИ.С., 1976;Peurin J.C.etal., 1988, и др.]. Развивается гипок-семия, энергетические затраты на дыхание резко увеличиваются. Если процесс не удается остановить, может возникнуть некардиогенный альвеолярный отек. В далеко зашедших стадиях «шокового лёгкого» в альвеолы проникает гиалин, развиваются гиалиновые мембраны, возникает истинное нарушение диффузии газов через альвеолярно-капиллярную мембрану.
Развитие «шокового лёгкого» можно условно разделить на 4 стадии [Золотокрылина E.G., 1977; Колесникова Е.К., 1980].
В I стадии (конец 1-х — начало 2-х суток) у больных развивается эйфория, они не осознают тяжести своего состояния, становятся беспокойными. Нарастают тахипноэ и тахикардия. В лёгких выслушивается жесткое дыхание. Повышается давление в легочной артерии, возникает гипоксемия, устраняемая ингаляцией кислорода, гипокапния. На рентгенограмме определяются усиление легочного рисунка, его ячеистость, мелкоочаговые тени. Морфологически эта стадия характеризуется интерстициальным отеком; могут быть кровоизлияния под висцеральную плевру. В этой стадии процесс обратим, при правильном лечении летальность близка к нулю.
Во II стадии (2—3-й сутки) больные возбуждены. У них отмечаются резкая одышка, стойкая тахикардия. В лёгких появляются зоны ослабленного дыхания. Возникает артериаль-
ная гипоксемия, резистентная к оксигенотерапии, и выраженная гипокапния. На рентгенограмме в лёгких определяются сливные тени, симптом «воздушной бронхографии»: на фоне затемнения прослеживаются содержащие воздух бронхи. Морфологически: значительное увеличение плотности и полнокровия лёгких, деформация альвеол с утолщением их стенок. В этой стадии летальность достигает уже 50—55 %.
Стадия III (4—5-е сутки) характеризуется диффузным цианозом кожных покровов, тахипноэ с малым дыхательным объемом. Больной откашливает скудную гнойную мокроту. В лёгких выслушиваются зоны «амфорического» дыхания. В артериальной крови выраженная гипоксемия, начинает по-
Таблица 1.1. Основные вентиляционные и газовые нарушения при различных формах ОДН
| Форма одн | Частота дыхания | ДО | МОД | ЖЕЛ | РаО2 | РаС02 |
| Центро-генная | Тахипноэ или бра-дипноэ, нарушения ритма | Может увеличиваться или снижаться | Чаще увеличен | Проверить не удается или снижена | Снижено | Чаще снижено |
| Нервно-мышечная | Увеличена или не изменена | Резко уменьшен | Уменьшив | Резко снижена | В условиях кислородной терапии может | Повышено |
| Торако-диафраг-мальная | Увеличена | То же | Резко уменьшен | Тоже | быть нормальным | Прогрессивно повышается |
| Бронхо-легочная обструк-тивная | Вначале снижена | Вначале увеличен | Увеличен | Вначале не изменена | Снижено | Снижено |
| Бронхо-легочная рестрик-тивная | Увеличена | Уменьшен | Увеличен | Прогрессивно снижается | Снижено | Снижено |
| Нарушение легочного кровообращения | Резко увеличена | Увеличен | Резко увеличен | Снижена | Резко снижено | Повышено |
вышаться РаССО2. На рентгенограмме множественные сливающиеся тени («снежная буря»), может быть выпот в плевральных полостях. Морфологически: белок и форменные элементы в альвеолах, отслаивание эпителия и утолщение капиллярной стенки, микротромбы в сосудах, множественные кровоизлияния в ткань лёгкого. Летальность достигает 65—75 %.
В IV стадии сознание обычно нарушено, сопор. Могут быть нарушения гемодинамики: аритмия сердца, снижение артериального давления. В лёгких множество влажных хрипов. Артериальная гипоксемия, резистентная к искусственной вентиляции лёгких с высоким содержанием кислорода во вдыхаемой газовой смеси. Гиперкапния. На рентгенограмме затемнение больших участков лёгких (доли, сегменты). Картина отека лёгких. Морфологически: альвеолярный отек, фибрин в альвеолах, гиалиновые мембраны в альвеолярных стенках, микротромбы в сосудах, фиброз легочной ткани. Летальность 90— 100 % [Неговский В.А. и др., 1979; Тимофеев И.В., 1991; Lamy M. et al., 1992, и др.].
Следует отметить, что появление гиалиновых мембран приводит к истинным нарушениям диффузии в лёгких, и РДСВ — одна из немногих форм ОДН, при которой развивается истинная диффузионная дыхательная недостаточность. Кроме того, необходимо иметь в виду, что для РДСВ характерна негомогенность поражения лёгких, в различных отделах изменения могут быть более или менее выраженными, соответственно имеются и существенные различия в растяжимости этих отделов [Gattinoni L. et al., 1988], что имеет большое значение при проведении респираторной терапии (см. главу 5).
В табл. 1.1. мы схематично приводим основные тенденции вентиляционных и газовых нарушений, характерных для описанных форм ОДН. Как и всякая схема, она не может претендовать на исчерпывающую полноту и универсальность и служит только для подведения некоторых итогов изложенного.
При оценке степени тяжести ОДН необходимо учитывать не только глубину гипоксии и (или) гиперкапнии, но и состояние компенсаторных функций организма. При этом надо иметь в виду положительные и отрицательные стороны усиленной компенсации, четко представлять себе, какими усилиями достигается устранение или уменьшение тканевой гипоксии и насколько оно полноценно.
При постепенном, в течение многих месяцев или лет, нарастании хронической дыхательной недостаточности одним из
важных компенсаторных механизмов является увеличение кислородной емкости крови за счет усиления эритропоэза. Однако при ОДН и быстро нарастающей гипоксемии этот способ компенсации не успевает наступить.
При ОДН одной из первых и основных реакций на гипоксе-мию является увеличение МОД. Оно достигается вначале увеличением дыхательного объема (если это возможно в данных условиях), а затем учащением дыхания. Увеличение глубины дыхания способствует снижению шунтирования крови справа налево и улучшению центральной гемодинамики, но при этом повышается потребление кислорода. Второй тип гипервентиляции — тахипноэ — менее выгоден в связи с большими энергозатратами. При увеличении МОД на 44 % суммарная энергетическая стоимость дыхания увеличивается более чем в 5 раз [Бондаренко А.В., 1995]. Наряду с этим при тахипноэ увеличивается отношение vd/vx и минутная альвеолярная вентиляция (Уд) возрастает непропорционально увеличению работы дыхания. При выраженном тахипноэ может наступить снижение va, несмотря на повышение МОД.
Н.М.Рябова (1974) различает четыре типа компенсаторной гипервентиляции при ОДН. При первом, наиболее физиологичном, типе МОД увеличивается только на 20—25 %, но УО2 возрастает более чем в три раза. Коэффициент использования кислорода (КиО2) значительно увеличен, РаСО2 умеренно снижено (31—33 мм рт.ст.). Жизненная емкость лёгких (ЖЕЛ) снижена до 15—18 % от должной. Этот тип компенсации характерен для больных с умеренными нарушениями гемодинамики, отсутствием выраженного снижения кислородной емкости крови. Компенсация достигается за счет увеличения дыхательного объема.
Второй тип компенсации — значительное увеличение МОД (на 85—90 %) и учащение дыхания, VO2 повышено втрое. Ки02 ниже, чем при первом типе. Выраженная гипокапния (РаСО2 25—28 мм рт.ст.).
Третий тип — крайнее напряжение компенсаторных механизмов. МОД увеличен в 2 раза и более за счет тахипноэ, но VO2 всего на 30—35 % превышает должные величины. КиО2 резко снижен. Глубокая гипокапния. ЖЕЛ составляет только 10— 13 % от должной.
Четвертый тип (вернее, стадия) — наступающая декомпенсация. МОД уменьшается и только на 30—35 % превышает должные величины. Дыхательный объем значительно снижен, гипервентиляция осуществляется за счет резкого увеличения частоты дыхания. ЖЕЛ равна дыхательному объему. VO2 начинает снижаться. КиО2 более чем в 2,5 раза ниже, чем при первом типе. РаСО2 начинает повышаться и приближаться к нормальным величинам, что свидетельствует о нарастаю-
щем уменьшении va- Работа дыхания увеличивается в 25 раз и более [Marini J.J., 1985], резервы дыхания практически отсутствуют.
А.В.Бондаренко (1995), который выделяет три стадии ОДН, возникающей после операций на лёгких, показал, что в первой стадии частота дыхания составляет 20—21 в мин, МОД около 10 л/мин, растяжимость лёгких 116 мл/см вод.ст., сопротивление дыхательных путей выдоху 4,3 см вод.ст./л х с"1, D(A—a)O2 30,4 мм рт.ст. При этом энергетическая цена дыхания равна 0,65 кал/мин. Во второй стадии частота дыхания и МОД нарастают, происходит дальнейшее ухудшение механических свойств лёгких и увеличение энергетической цены дыхания, и при третьей стадии частота дыхания 26—27 в мин, МОД более 15 л/мин, растяжимость лёгких 69 мл/см вод.ст., сопротивление дыхательных путей 7,9 см вод.ст./л х с"1. При этом энергетическая цена дыхания равна 3,68 кал/мин (т.е. в 5,7 раза больше, чем в первой стадии), что автор справедливо рассматривает как максимальное напряжение компенсаторных механизмов, связанное не только с увеличением МОД за счет возрастания частоты дыхания, но и с ухудшением механических свойств лёгких. Важно отметить, что, несмотря на резкое увеличение работы дыхания, D(A—а)О2 увеличивается до 45—46 мм рт.ст. и РаО2 снижается с 75 до 60 мм рт.ст.
Другим, тоже очень рано включающимся компенсаторным механизмом является увеличение транспорта кислорода. В ответ на снижение оксигенации тканей увеличивается сердечный выброс. Однако при этом также имеют место два механизма компенсации: увеличение ударного объема (благоприятный тип компенсации) и увеличение частоты сердечных сокращений и сердечного индекса без возрастания ударного (неблагоприятный тип компенсации). При тахикардии, как правило, развивающейся у больных с ОДН, значительно увеличивается потребление кислорода миокардом и истощаются резервы последнего.
При повышенном VO2 70 % кислородной потребности обеспечивается увеличением сердечного выброса, а 30 % за счет повышенной экстракции кислорода тканями. Следовательно, ткани потребляют кислород при его более низком парциальном давлении, что проявляется снижением PvO2, А это значит, что и в тканях снижается напряжение кислорода. Когда к этому присоединяется падение сердечного выброса вследствие истощения миокарда, развивается тяжелая гипоксия тканей. Снижение сердечного индекса до 1 л/мин х м~2 и РуО2 до 25 мм рт.ст. представляет прямую угрозу развития необратимых гипоксических изменений в паренхиматозных органах. Особенно быстро декомпенсация кровообращения наступает при вторичной ОДН.
Одним из компенсаторных механизмов является расширение капиллярной сети, в результате чего увеличивается её пропускная способность. Эта реакция возникает чаще всего в ответ на гиперкапнию. Однако расширение капилляров быстро приводит к стазу в них, депонированию и сгущению крови, экстравазаци'и жидкости. Таким образом, транскапиллярный обмен падает, и временно увеличенная доставка кислорода к тканям снижается ниже исходного уровня.
Наконец, при накоплении в организме недоокисленных продуктов обмена и связанной угольной кислоты (бикарбоната) они начинают усиленно выделяться с мочой. При этом в почечных канальцах увеличивается реабсорбция гидрофильных ионов натрия. Это приводит к задержке натрия и воды в организме и олигурии.
Таким образом, ОДН приводит в действие целый комплекс сложных компенсаторных механизмов, несовершенство которых заложено в самой их основе. После определенного периода напряжения функций ряда систем (в первую очередь дыхания и кровообращения) наступает их декомпенсация.
|
|
|
|
|
Дата добавления: 2015-05-29; Просмотров: 2719; Нарушение авторских прав?; Мы поможем в написании вашей работы!