
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Взаємодія з водою[ред. • ред. код]Оцтовий альдегід вступає у оборотну реакцію гідратації, утворюючи відповідний гідрат
|
|
|
|
Етаналь у водному розчині гідратований на 51 %[3].
Взаємодія зі спиртами[ред. • ред. код]
Спирти, як і вода, оборотно приєднуються до етаналю з утворенням півацеталей. В спиртових розчинах півацеталіперебувають у рівновазі з оцтовим альдегідом. Так, в етанольному розчині етаналю міститься близько 30 % півацеталю (1-етоксиетанолу) (в розрахунку на альдегід).
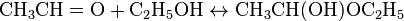
|
При взаємодій з другою молекулою спирту в умовах кислотного каталізу півацеталі перетворюються в ацеталі.
Взаємодія з амінами[ред. • ред. код]
На першій стадії реакції відбувається нуклеофільне приєднання аміну за подвійним зв'язком  карбонільної групи. Первинним продуктом приєднання є біполярний іон, який стабілізується в результаті внутрішньомолекулярного перенесення протона від атома Нітрогену до атому Оксигену, перетворюючись нааміноспирт[ru]. Однак реакція не зупиняється на цій стадії, адже сполуки, що містять дві електроноакцепторні групи при одному атомі Карбону, нестійкі і прагнуть до стабілізації шляхом відщеплення однієї з груп у вигляді нейтральної термодинамічно стабільної молекули. В даному випадку відбувається відщеплення молекули води від молекули аміноспирту і утворюється імін (основа Шиффа).
карбонільної групи. Первинним продуктом приєднання є біполярний іон, який стабілізується в результаті внутрішньомолекулярного перенесення протона від атома Нітрогену до атому Оксигену, перетворюючись нааміноспирт[ru]. Однак реакція не зупиняється на цій стадії, адже сполуки, що містять дві електроноакцепторні групи при одному атомі Карбону, нестійкі і прагнуть до стабілізації шляхом відщеплення однієї з груп у вигляді нейтральної термодинамічно стабільної молекули. В даному випадку відбувається відщеплення молекули води від молекули аміноспирту і утворюється імін (основа Шиффа).
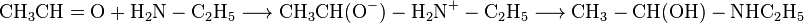
|
Подібно до взаємодії з первинними амінами проходять реакції етаналю з такими похідними амоніаку, якгідроксиламін 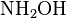 , гідразин
, гідразин 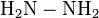 , фенілгідразин C6H5NHNH2 та ін. Утворені похідні оцтового альдегіду — оксими, гідразони, фенілгідразони — зазвичай є стійкими кристалічними речовинами з чіткимитемпературами плавлення.
, фенілгідразин C6H5NHNH2 та ін. Утворені похідні оцтового альдегіду — оксими, гідразони, фенілгідразони — зазвичай є стійкими кристалічними речовинами з чіткимитемпературами плавлення.
Відновлення[ред. • ред. код]
Етаналь відновлюється до етанолу. Одним із ефективних відновників є алюмогідрид літію LiAlH4. Він відіграє роль постачальника гідрид-іонів H-, які є нуклеофільними частинками і приєднуються за подвійним зв’язком 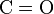 . Для перетворення утвореного спочатку алкоксид-іону в спирт після закінчення відновлення в реакційне середовище додають воду.
. Для перетворення утвореного спочатку алкоксид-іону в спирт після закінчення відновлення в реакційне середовище додають воду.
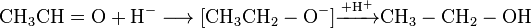
|
В промисловості етаналь перетворюють в етанол в результаті каталітичної гідрогенізації. Реакцію проводять, пропускаючи випари альдегіду в суміші з воднем над нікелевим або паладієвим каталізатором.
Альдольно-кротонова конденсація[ред. • ред. код]
В результаті взаємодії в лужному середовищі двох молекул етаналю утворюється 3-гідроксибутаналь.
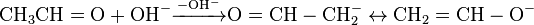
|
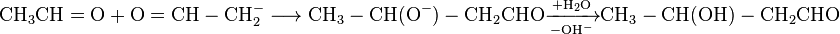
|
Оскільки продукт реакції містить в молекулі гідроксильну і альдегідну групи, його назвали альдолем (від слів альдегід і алкоголь), а сама реакція конденсації оксосполук в лужному середовищі отримала назву альдольної конденсації. Ця реакція має велике значення в органічному синтезі, оскільки дозволяє синтезувати різні гідроксикарбонільні сполуки. Альдольну конденсацію можна проводити в змішаному варіанті, з використанням різних карбонільних сполук.
Часто альдольна конденсація супроводжується відщепленням води і утворенням α,β-ненасиченої карбонільної сполуки. У такому випадку реакція називається кротоновою
Етаналь застосовують в промисловості для виробництва ацетатів целюлози, оцтової і пероцтової кислот, оцтового ангідриду, етилацетату, гліоксалю, 2-етилгексанолу, алкіламінів, бутанолу, пентаеритриту, алкілпіридинів, 1,3-бутиленгліколю, хлоралю. Також використовується як відновник у виробництві дзеркал.
Світове виробництво у 1982 році становило 2 млн т/рік (без СРСР)[6].
40 Гліцери́н (гліцеро́л) — трьохатомний спирт. Хімічна формула — C3H8O3, або C3H5(OH)3. З водою гліцерин змішується в усіх пропорціях, причому об'єм такого розчину буде трохи менший від суми первинних об'ємів води й гліцерину. В усіх пропорціях змішується з етанолом. Не розчиняється в жирах, олії, бензині,хлороформі.[3]
Наявність гідроксильних груп зумовлює подібність гліцерину до одноатомних спиртів, він вступає в ті самі реакції, але за участю трьох гідроксильних груп.
Реакції повного окиснення (горіння) відбувається, як і в інших органічних речовин, з утворенням вуглекислого газу іводи.
Гліцерин вступає в реакцію заміщення з металічним натрієм, яка супроводжується виділенням водню.
Реакції[ред. • ред. код]
· Горіння:
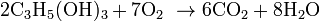
· Взаємодія з металічним натрієм:
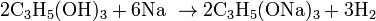
· З нерозчинними основами:
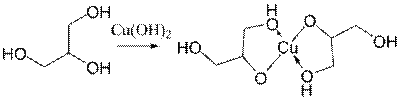
У промисловості його отримують головним чином при гідролітичному розщепленні жирів. Гліцерин випускають трьох видів — сирий, дистильований та технічно чистий. В косметиці дозволено застосування двох останніх. Гліцерин гігроскопічний. Завдяки властивості поглинати з повітря до 40-50 % води по відношенню до його початкової маси, він отримав широке розповсюдження в косметиці, як речовина, що швидко відбирає воду з тваринної та рослинної тканини. Вінзастосовується майже у всіх косметичних препаратах як пом'якшуючий засіб та є одним з основних видів сировини для виготовлення зубних паст. Він не засихає, не гіркне, замерзає при дуже низьких температурах і тому застосовується як речовина, що перешкоджає висиханню та замерзанню косметичних виробів.Гліцерин використовується в парфумерії та фармації як зм'якшувальний засіб або основа мазей, добавка до масла, ухарчовій промисловості — як добавка до напоїв. Спиртовий розчин тринітрогліцерину має судинорозширювальну дію й у вигляді ліків використовується при серцевих захворюваннях. Гліцерин, його олігомери і полімери запропоновані в якості засобів, які зберігають свіжість харчових продуктів.У шкіряному виробництві та текстильній промисловості — для обробки пряжі і шкіри з метою їх пом'якшення та надання еластичності. Гліцерин застосовується в тютюновій промисловості, при виробництві поліуретанів, гуми,фанери, барвників, чорнил і паст, зубної пасти, емульгаторів, фотографічних і інших матеріалів.З гліцерину добувають вибухову речовину тринітрогліцерин, що використовується для виготовлення динаміту.Гліцерин в якості кормової добавки підвищує надої молока.[5]
43 Глюко́за (від грец. γλυκύς — солодкий) (виноградний цукор, декстроза), С6Н12О6 — важливий моносахарид; білі кристали солодкі на смак, легко розчиняються у воді.
Знаходиться в соку винограду, в багатьох фруктах, а також у крові тварин і людей.
М'язова робота виконується головним чином за рахунок енергії, яка виділяється при окисленні глюкози.
Глюкоза отримується при гідролізі полісахаридів крохмалю і целюлози (під дією ферментів або мінеральних кислот).
Використовується як засіб посиленого харчування або як лікарська речовина, при обробці тканини. Також препарати на основі глюкози та сама глюкоза використовується у медицині при визначенні наявності та типу цукрового діабету в людини.
Природна кристалічна глюкоза (виноградний цукор) являє собою циклічну альфа-формулу. При розчиненні в воді вона переходить в ланцюгову, а через неї в бета-форму; при цьому установлюється динамічна рівновага між усіма формами.
Бета-форма також може бути виділена в кристалічному вигляді; у водному розчині вона утворює рівноважну систему з іншими формами.
Ланцюгова форма існує лише в розчинах, причому в дуже невеликій кількості, а в вільному вигляді не виділена.
Ізомерні форми сполук, які здатні переходити одна в одну називають таутомерними формами чи таутомерами. Явище таутомерії дуже розповсюджене серед органічних сполук.
41Основні способи отримання спиртів вже розглядалися при реакційної здатності галогенпохідних, елементоорганічних сполук і алкенів. Особливо слід виділити отримання метанолу і етанолу. Спирти — похідні вуглеводнів, у молекулах яких один або кілька атомів Гідрогену заміщені гідроксильними групами (-OH). Гідроксильну групу зв'язану з sp3-гібридизованим атомом Карбону називають спиртовою. Органічні сполуки з двома гідроксильними групами називаються діолами, з трьома — тріолами і т. д. В українській мові їх також називають багатоатомними спиртами
45 Білки́ — складні високомолекулярні природні органічні речовини, що складаються з амінокислот, сполучених пептидними зв'язками. В однині (білок) термін найчастіше використовують для посилання на білок як речовину, коли неважливий її конкретний склад, та на окремі молекули або типи білків, у множині (білки) — для посилання на певну кількість білків, коли точний Білки також характеризуються ізоелектричною точкою (pI) — кислотністю середовища pH, при якому молекула даного білка не несе електричного заряду. Чим більше в даному білку гідроксильних груп (основних залишків), тим вище за нього pI. Білки з pI меншим за 7 називаються кислотними, а білки з pI більшим за 7 — основними. В цілому, pI білка залежить від функції, яку він виконує, так білки, що зв'язуються з нуклеїновими кислотами часто відносяться до основних білків. Прикладом таких білків служать гістони.
За ступенем розчинності у воді білки бувають розчинними (гідрофільними) і нерозчинними (гідрофобними). До останніх відносяться більшість білків, що входять до складу біологічних мембран, тобто інтегральних мембранних білків, які взаємодіють з гідрофобними ліпідами мембрани[13].склад важливий.
46Фено́л (гідроксибензол, стара назва — карболова кислота) C6H5OH — органічні сполуки, в молекулах яких, гідроксильні групи сполучені безпосередньо з бензольним кільцем. Фенол називають карболовою кислотою, хоча це дуже слабка кислота. Карболова кислота, під більш відомою в побуті назвою "карболка" використовувалась раніше як асептик. 1. Горіння
2С6H5OH + 14O2 → 12CO2 + 6H2O
2. Взаємодія з лугами
С6H5OH + NaOH → С6H5ONa + H2O
У цій реакції фенол поводить себе як кислота, що нейтралізує луг, утворюючи сіль (в приведеній реакції утворюється фенолят натрію) і воду. Зважаючи на кислотні властивості фенолу, його називають ще карболовою кислотою, хоч це дуже слабка кислота.
Реакції за бензольним ядром. Бензол не реагує з бромною водою. Якщо ж до розчину фенолу додати бромну воду, відбудеться реакція заміщення (бромування) з утворенням білого осаду трибромо-фенолу:
Бензольне ядро впливає на гідроксильну групу, полегшується відщеплення гідроксильного гідрогену і фенол виявляє кислотні властивості; гідроксильна група, в свою чергу, впливає на бензольне ядро, полегшуючи заміщення гідрогенових атомів ядра і фенол реагує з бромною водою.
Характерною реакцією фенолу, за якою його можна виявити серед інших речовин, є реакція з розчином хлориду феруму(ІІІ) Унаслідок зливання розчинів речовин утворюється сполука фіолетового кольору:
С6H5OH + FeCl3 → (C6H5O)3Fe + 3HCl
Застосування[ред. • ред. код]
Фенол було вперше виділено з кам'яновугільної смоли в першій половині XIX століття. Його застосування тісно пов'язане з розвитком синтетичної органічної хімії. Фенол є вихідною речовиною для виробництва барвників,лікувальних препаратів, пластичних мас, вибухових речовин. Фенол має антисептичні властивості, які були виявлені ще у другій половині XIX століття. Вони зумовлюють використання його 5% розчину для знезаражування приміщень, хірургічних інструментів, фенол додають до деяких сортів мила, ним протравлюють деревину, щоб запобігти її гниттю. Разом з тим фенол токсична речовина, що може спричинити опіки шкіри. Оскільки фенол є продуктомкоксохімічної промисловості, то вкупі з іншими промисловими викидами він потрапляє у стічні води, тим самим забруднює навколишнє середовище.
47Органі́чні сполу́ки — клас сполук, в склад яких входить сполука Карбон (за винятком карбідів, карбонатної кислоти,карбонатів, оксидів Карбону і ціанідів). Окрім Карбону, вони майже завжди містять Гідроген, досить часто — Оксиген,Нітроген та галогени, рідше Фосфор, Сульфур та інші елементи. В органічних сполуках Карбон завжди виявляєвалентність IV. До органічних сполук належать не тільки природні речовини, які отримуються при розвитку рослин, або в результаті життєдіяльності тварин, але і багато штучно отриманих в лабораторії речовин. До складу органічних молекул органічних речовин поруч з вуглецем входять деякі хімічні елементи. Це насамперед водень, кисень, азот, сірка, галогени і фосфор. Інші елементи рідко зустрічаються в органічних сполуках; органічні речовини, які містять благородні гази, невідомі. Незважаючи на незначну кількість елементів, які входять до складу неорганічних сполук, кількість органічних сполук набагато переважає кількість неорганічних. Сьогодні відомо понад сім мільйонів органічних речовин.
Однією з важливих особливостей органічних сполук, яка накладає відбиток на всю хімічну поведінку, є характер зв'язків між атомами в їх молекулах. У переважній більшості випадків ці зв'язки мають яскраво виражений ковалентний характер. Тому органічні сполуки, як правило, не дисоціюють на йони і порівняно повільно взаємодіють один з одним. Тоді як реакції між електролітами в розчинах протікають майже миттєво, час, необхідний для завершення тієї або іншої реакції між органічними речовинами, звичайно вимірюється годинами, а іноді і днями. От чому в органічній хімії велике значення має застосування різних каталізаторів. Інша характерна риса органічних сполук полягає в їхній схильності піддаватися при нагріванні без доступу повітря глибоким змінам, в результаті котрих утворюються нові речовини, які мають абсолютно інші властивості. Якщо ж вести нагрівання при доступі повітря або у присутності окисників, то органічні речовини згорають, причому вуглець і водень що входять до їх складу цілком перетворюються на двоокис вуглецю і воду, а азот звичайно виділяється у вільному стані. На цьому заснований елементний аналіз органічних речовин: вміст вуглецю і водню в згорілій речовині визначають за кількістю двоокису вуглецю і води, які утворилися, азот, що виділився, вимірюють безпосередньо, а вміст кисню встановлюють за різницею між вагою згорілої речовини і вагою решти елементів, що містилися в ньому. Дані аналізу і визначення молекулярної ваги дозволяють вивести молекулярну формулу органічної речовини. Проте на відміну від неорганічних сполук молекулярна формула органічної речовини ще не дає уявлення ні про його характер, ні про його властивості. Річ у тому, що відомо дуже багато органічних сполук, які мають однаковий склад і однакову молекулярною вагу, але абсолютно різні фізичні і навіть хімічні властивості. Це явище, широко поширене серед органічних сполук, одержало назву ізомерії, а речовини, що відповідають одній і тій же молекулярній формулі, але відрізняються за своїми властивостями, називаються ізомерами. Пояснення різних випадків ізомерії дає теорія будови органічних сполук, створена в шестидесятих роках позаминулого сторіччя Бутлеровим, згідно з якою властивості речовин визначаються не тільки їх якісним і кількісним складом, як вважали раніше, але і внутрішньою будовою молекул, певним порядком з'єднаних між собою атомів, утворюючих молекулу. Цей внутрішній устрій Бутлеров назвав «хімічною будовою». Особливо важливою була ідея Бутлерова про те, що атоми, з'єднуючись хімічно в певній послідовності відповідно до їх валентності, взаємно впливають один на одного таким чином, що частково змінюється їх власна природа, їх «хімічний зміст». Вчення Бутлерова про хімічну будову молекул складають теоретичну основу органічної хімії.
48 Етиле́н або етен (IUPAC) — С2Н4, найпростіший і найважливіший представник ряду ненасичених вуглеводнНа відміну від метану етилен хімічно досить активний. Для нього характерні реакції приєднання за місцем подвійного зв'язку, реакції полімеризації і реакції окиснення. При цьому один з подвійних зв'язків розривається і на його місці залишається простий одинарний зв'язок, а за рахунок звільнених валентностей відбувається приєднання інших атомів або атомних груп. Розглянемо це на прикладах деяких реакцій. При пропусканні етилену у бромну воду (водний розчин брому) остання знебарвлюється внаслідок взаємодії етилену з бромом з утворенням диброметану (бромистого етилену) C2H4Br2:
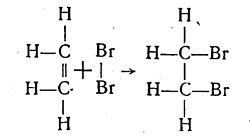
Як видно зі схеми цієї реакції, тут відбувається не заміщення атомів водню атомами галогену, як у насичених вуглеводнів, а приєднання атомів брому по місцю подвійного зв'язку. Етилен легко знебарвлює також фіолетовий колір водного розчину перманганату калію KMnO4 навіть при звичайній температурі. Сам же етилен при цьому окислюється в етиленгліколь C2H4(OH)2. Цей процес можна зобразити такими рівняннями:

Реакції взаємодії етилену з бромом і перманганатом калію служать для відкриття ненасичених вуглеводнів. Метан і інші насичені вуглеводні, як уже відзначалось, з перманганатом калію не взаємодіють.
Етилен вступає в реакцію з воднем. Так, коли суміш етилену з воднем нагріти в присутності каталізатору (порошкунікелю, платини або паладію), то вони сполучаються з утворенням етану:
Реакції, при яких відбувається приєднання водню до речовини, називаються реакціями гідрування або гідрогенізації. Реакції гідрогенізації мають велике практичне значення. їх досить часто використовують у промисловості. На відміну від метану етилен горить на повітрі світящим полум'ям, оскільки містить більше вуглецю, ніж метан. Через це не весь вуглець згоряє відразу і частинки його сильно розжарюються і світяться. Потім ці частинки вуглецю згоряють у зовнішній частині полум'я:
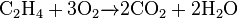
З повітрям етилен, як і метан, утворює вибухові суміші.
ів з одним подвійним зв'яВ сучасній промисловості етилен застосовується досить широко для синтезу етилового спирту і виробництва важливих полімерних матеріалів (поліетилен та ін.), а також для синтезу інших органічних речовин. Дуже цікавою є властивість етилену прискорювати достигання багатьох городніх і садових плодів (помідорів, динь, груш, лимонів тощо). Використовуючи це, плоди можна транспортувати ще зеленими, а потім доводити їх до стиглого стану уже на місці споживання, вводячи в повітря складських приміщень невеликі кількості етилену.
З етилену виробляють хлористий вініл і полівінілхлорид, бутадієн і синтетичні каучуки, оксид етилену та полімери на його основі, етиленгліколь тощо.[2
49 Анілі́н — C6H5NH2 органічна сполука, найпростіший ароматичний амін. Безбарвна рідина, малорозчинна у воді, змішується зі спиртом, ефіром,бензеном; під впливом повітря швидко темніє, стає коричневою. Пара його отруйна. Амінобензол утворює солі з мінеральними кислотами:

Під дією нітритної кислоти на солі аніліну утворюються діазосполуки, які широко застосовують у виробництві барвників.
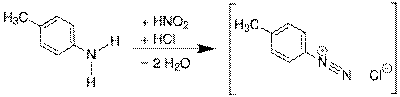
Застосовується також у виробництві фармацевтичних препаратів, вибухових речовин, полімерів, прискорювачів вулканізації каучуку.
50 Етано́л (інші назви: етиловий спирт, винний спирт, алкоголь; формула: С2Н5ОН) — це сильна психоактивна речовина і один з найстарішихнаркотиків, протоплазматична отрута; головна діюча складоваалкогольних напоїв, які зазвичай виготовляються збродженням здатних доферментації вуглеводів. Пиво вживали ще у прадавньому Вавилоні, а виготовлення вина відомо з п'ятого тисячоліття до н. е.[4] Можливе отримання вільного етанолу дистиляцією вперше було задокументованоарабськими алхіміками приблизно у 10-му сторіччі[ Джерело? ].
Залежно від вмісту води, способу отримання та мети використання існує багато різних етаноловмісних продуктів. Найбільш широкого вжитку набула суміш 95,6 мас. % етанолу та 4,4 мас. % води, такий вміст етилового спирту максимально можливий за звичайної фракційної перегонки, бо це співвідношення утворює азеотропну суміш з температурою кипіння 78,15 °C. Етанол є одноатомний первинним спиртом. Обидва атоми Карбону в молекулі етанолу, в тому числі атом, який зв'язаний з гідроксильною групою, знаходяться в sp3-гібридизації.
Гідроксильна група надає етанолу слабкі лужні властивості, хоча він майже нейтральний, як вода. pH 100% етанолу 7,33, порівняно з 7 для води. Однак етанол реагує з лужними металами, такими як натрій, проявляючи свої кислотні властивості:
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2, Він також реагує з сильними лугами: CH3CH2OH + NaOH → CH3CH2ONa + H2O.
У воді ця реакція не відбувається, оскільки вода кисліша, тож гідроксидутворюється швидше, ніж етоксид.
|
|
|
|
Дата добавления: 2015-06-04; Просмотров: 1414; Нарушение авторских прав?; Мы поможем в написании вашей работы!