
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Каталитические процессы
|
|
|
|
Основы технического катализа (общие положения)
1. Катализаторы и каталитические реакции
Катализатором называют вещество, многократно вступающее в промежуточное химическое взаимодействие с реагентами, не участвующее в стехиометрическом уравнении реакции, не изменяющее термодинамическое равновесие, но увеличивающее скорость его достижения, т.е. скорость реакции.
То, что катализатор не участвует в стехиометрическом уравнении реакции, не означает неизменности его состава и свойств. Так, под влиянием регентов, примесей к реагентам, основных и побочных продуктов реакции, температуры катализатор всегда претерпевает физико-химические изменения.
Иногда, в результате взаимодействия с одним из продуктов реакции свойства катализатора изменяются очень быстро, но при удалении этого продукта он восстанавливает свои первоначальные свойства – регенерируется.
Катализатор не влияет на термодинамическое равновесие реакции, если можно пренебречь изменением энергии Гиббса в результате образования стабильных продуктов взаимодействия реагентов или продуктов реакции с катализатором. Обычно изменением  реакции под влиянием катализатора можно пренебречь, т.к. образование продуктов побочной реакции с катализатором очень мало относительно образования основных продуктов реакции.
реакции под влиянием катализатора можно пренебречь, т.к. образование продуктов побочной реакции с катализатором очень мало относительно образования основных продуктов реакции.
Равенство изменения энергии Гиббса при реакции в присутствии катализатора и без него означает, что катализатор в одинаковой степени ускоряет и прямую и обратную реакции. Если реакция проводится в условиях, близких к равновесным, то данный катализатор можно применять для ускорения как прямой, так и обратной реакции (например, гидрирование и дегидрирование).
Многие реакции чисто термически, без использования катализатора, не осуществляются вообще (например, изомеризация парафиновых углеводородов). Однако, термодинамически эти реакции возможны, и применение катализатора позволяет осуществить их. Катализатор воздействует на реакцию в результате промежуточного химического взаимодействия с реагирующими веществами, которое открывает новый, невозможный без катализатора путь реакции, состоящий, как правило, из большого числа элементарных стадий, чем в отсутствие катализатора.
2. Влияние энергии активации на протекание химической реакции
Скорости некаталитических и каталитических реакций связаны с энергией активации и в газовой фазе, если протекает мономолекулярная реакция  равны:
равны:
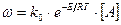
Для мономолекулярных реакций:
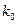 тер
тер  , но не может быть меньше этого значения;
, но не может быть меньше этого значения;
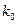 каt
каt 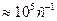 , но не может быть больше этого значения и равно удельному числу соударений молекул с поверхностью (S) катализатора.
, но не может быть больше этого значения и равно удельному числу соударений молекул с поверхностью (S) катализатора.
Чтобы каталитическая реакция осуществлялась, энергия активации ее должна быть ниже, чем некаталитической. Т.о., энергия активации каталитической реакции всегда меньше энергии активации той же реакции, но протекающей без катализатора, т.е. термической. Почему же  ? Потому что каталитическая реакция более сложная и состоит из большего числа элементарных стадий, а
? Потому что каталитическая реакция более сложная и состоит из большего числа элементарных стадий, а  любой стадии всегда меньше
любой стадии всегда меньше  . В этом и заключается основное условие катализа.
. В этом и заключается основное условие катализа.
Зависимость энергии активации от пути реакции можно рассмотреть графически:
где: 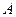 - исходный реагент;
- исходный реагент;
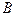 - конечный продукт;
- конечный продукт;
 - катализатор;
- катализатор;
 - энергия активации;
- энергия активации;
 - тепловой эффект.
- тепловой эффект.
3. Классификация каталитических реакций и катализаторов
Все катализаторы, применяемые в нефтепереработке и нефтехимии, по характеру взаимодействия катализатора с реагирующими веществами и по типу промежуточных продуктов разделяют на кислотно-основные и окислительно-восстановительные.
В кислотно-основных реакциях промежуточными активными частицами являются ионы, и катализатор инициирует их образование в результате передачи протонов от катализатора к реагенту или от реагента к катализатору. Катализаторами в этом случае являются кислоты (кислотный катализ) и основания (основной катализ).
В окислительно-восстановительных реакциях промежуточными активными частицами являются радикалоподобные нейтральные образования и каталитическое воздействие связано с переходом электрона от молекулы катализатора к молекуле реагента и наоборот.
Кислотно-основные и окислительно-восстановительные функции катализаторов могут быть совмещены и тогда катализаторы имеют двойную активность, т.е. называются бифункциональными катализаторами.
Многие промышленные катализаторы являются бифункциональными, т.к. окислительно-восстановительный катализатор наносят на носитель, являющийся кислотным катализатором.
В нефтеперерабатывающей промышленности:
1. к кислотному катализу можно отнести:
· каталитический крекинг;
· алкилирование изобутана бутеном;
· полимеризацию олефинов.
2. к окислительно-восстановительному:
· гидрогенизацию и дигидрогенизацию.
3. бифункциональный катализ широко применяется в процессах:
· риформинга;
· гидрокрекинга;
· изомеризации парафиновых углеводородов.
Катализ основаниями в нефтеперерабатывающей промышленности не применяется.
4. Гомогенный и гетерогенный катализ
В зависимости от того, находится ли катализатор в той же фазе, что и реагирующие вещества, или образуют самостоятельную фазу, говорят о гомогенном или гетерогенном катализе.
Если реагенты и катализатор находятся в одной фазе (газовая смесь или раствор), то осуществляется гомогенный катализ.
При гетерогенном катализе катализатор – твердое вещество, а реагенты – жидкие или газообразные вещества. Реакция в этом случае протекает на поверхности катализатора. Гетерогенный катализ распространен в нефтеперерабатывающей промышленности значительно больше, чем гомогенный.
5. Основные стадии гетерогенного каталитического процесса
Реакция газообразных реагентов на твердом катализаторе складывается из следующих стадий:
1. диффузия реагентов из газового потока к внешней поверхности частиц катализатора (внешняя диффузия).
2. диффузия реагентов в поры катализатора (внутренняя диффузия).
3. адсорбция реагентов на поверхность катализатора.
4. химическая реакция на поверхности катализатора.
5. десорбция продуктов реакции.
6. диффузия продуктов реакции в порах катализатора.
7. диффузия продуктов реакции от внешней поверхности частиц катализатора в газовый поток.
При этом стадии (2) - диффузия реагентов в поры катализатора и (6) - диффузия продуктов реакции в порах катализатора осуществляются только на пористом катализаторе.
При установившемся режиме скорости всех стадий равны. Обычно одна из стадий является лимитирующей, т.е. скорость которой предельна и не может повыситься при повышении скорости остальных стадий. В зависимости от того, какая из стадий является лимитирующей, различают следующие области протекания реакции:
1. Внешнедиффузионная область
Скорость реакции, протекающей во внешнедиффузионной области, практически не зависит от температуры, а зависит от скорости потока и размера частиц катализатора. Поверхность пор катализатора и его активность на скорость реакции в этом случае не влияют.
Если основная и побочная реакции имеют одинаковые порядки и побочная реакция имеет значительно большую энергию активации, чем основная, то при протекании реакции во внешнедиффузионной области побочная реакция может сильно ускориться относительно основной.
2. Внутридиффузионная область
Протекание реакции в этой области обусловлено наличием пор в катализаторе.
Если реакция протекает медленно относительно внешней диффузии, то молекулы реагентов диффундируют в поры катализатора. По мере протекания реакции по длине пор катализатора концентрация реагентов уменьшается.
Если реакция протекает достаточно быстро, то уже недалеко от устья поры концентрация реагентов равна 0, и реакция проходит только на части поверхности поры. Такой механизм протекания реакции называется внутридиффузионным.
В данном случае необходимо учитывать соотношение между диаметром пор катализатора и их длиной. В противном случае будет отсутствовать процесс столкновения молекул реагентов об стенки катализатора и между собой.
3. Кинетическая область
Если реакция на поверхности быстрее диффузии в поры, но медленнее внешней диффузии, то реакция также протекает на поверхности катализатора независимо от диффузии. Это случай протекания реакции во внешней кинетической области.
Если скорость процесса определяется механизмом реакции на всей внутренней и внешней поверхности катализатора, то процесс проходит во внутренней кинетической области.
В первом случае скорость реакции пропорциональна внешней поверхности частиц катализатора, во-втором – его удельной поверхности.
Скорость реакции в кинетической области может определяться:
· Скоростью адсорбции;
· Скоростью реакции на поверхности адсорбированных молекул;
· Скоростью реакции молекул, соударяющихся из газовой фазы с адсорбированными молекулами;
· Скоростью десорбции.
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 1080; Нарушение авторских прав?; Мы поможем в написании вашей работы!