
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химизм и механизм реакций каталитического крекинга
|
|
|
|
Катализ кислотами широко применяется в НПП. Каталитическое действие кислот обусловлено образованием при их взаимодействии с углеводородами катионов, называемых карбоний-ионами. Карбоний-ион - это промежуточная структура, в которой водорода на один атом меньше, чем в исходной молекуле парафинов и нафтенов, и на один атом водорода больше, чем в исходной молекуле олефинов и замещенных ароматических углеводородов.
При термическом крекинге через свободные радикалы промежуточные продукты также содержат на один атом водорода меньше, чем исходные молекулы. Отсюда в обоих случаях промежуточная структура углеводорода всегда содержит нечетное число атомов водорода. При каталитическом крекинге такая структура существует в ионной форме, а при термическом крекинге она появляется в форме свободного радикала.
Для каталитического крекинга типичным является ионное, гетеролитическое расщепление связи С-С, которое выражается следующей электронной структурой: 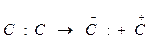 (260 кДж/моль).
(260 кДж/моль).
В противоположность этому для термического крекинга характерно свободнорадикальное расщепление связи С-С: С:С → С· + С· (74 кДж/моль).
С энергетической точки зрения между этими вариантами имеется существенное различие, поскольку в то время, как для разделения, например, н-гексана на два пропильных радикала требуется только 76 кДж/моль, а для разделения н-гексана на два н-пропильных иона, положительный и отрицательный, необходимо около 260 кДж. Тем не менее для образования такой пары ионов не требуется большого количества энергии, так как ионный механизм в качестве предварительной стадии предусматривает образование положительного иона с переносом протона, и эта стадия инициируется ионным каталитическим реагентом. Предполагается, что заряженные осколки находятся в тесной близости со своими партнерами и с катализатором.
По-видимому, в начальной стадии инициирования образования карбоний ионов происходит термическое расщепление углеводородов с образованием олефинов, которое над кислотным катализатором быстро образуют ионы карбония R+.
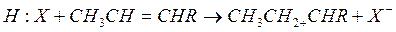
Кислоты Льюиса являются энергичными акценторами электронной пары и также могут инициировать реакцию с участием карбоний иона:

Образование карбоний ионов облегчается, если в системе имеется небольшое количество галогеналкинов: 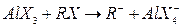
Галогеналкилы здесь играют роль промоторов.
Карбоний ионы очень реакционно-активные соединения. Константы скорости ионных реакций на несколько порядков выше аналогичных радикальных реакций. Об относительной устойчивости карбоний ионов можно судить по теплоте их образования (кДж/моль):
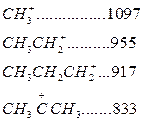 ↓ устойчивость возрастает
↓ устойчивость возрастает
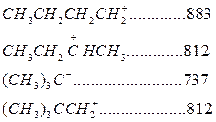 ↓ устойчивость возрастает
↓ устойчивость возрастает
Как следует из этих данных, стабильность карбоний ионов возрастает в последовательности: первичный < вторичный < третичный.
Основными реакциями карбоний ионов, как и радикалов, являются мономолекулярный β-распад и бимолекулярные реакции замещения и присоединения. Существенной реакцией также является изомеризация карбоний иона.
Кратко рассмотрим механизм превращения углеводородов в каталитическом крекинге.
1. Инициирование цепи
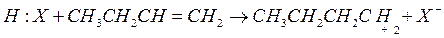
2. Изомеризация карбоний иона
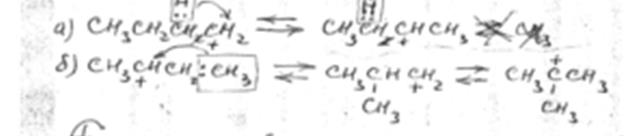
по схеме «а» изомеризация осуществляется за счет переноса гидрид иона, а по схеме «б» - за счет переноса метил иона.
Перемещение заряда происходит в направлении от первичного иона карбония к вторичному и далее к наиболее устойчивому – третичному. Реакция экзотермична.
3. β-распад. Расщепление карбоний иона обычно происходит по наиболее слабой связи β С-С.
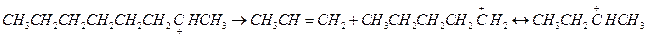
Склонность к β-распаду снижается в порядке первичный > вторичный > третичный карбоний ион. Так, для распада первичного октил иона требуется 92 кДж/моль.
Склонность к распаду увеличивается при отщеплении вторичного иона и еще больше увеличивается при отщеплении третичного иона
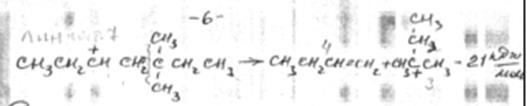
Сопоставление энергетики распада и изомеризации карбоний ионов показывает, что изомеризация должна предшествовать в большинстве случаев распаду. Преимущественное образование третичных карбоний ионов и их устойчивость должны приводить к накоплению углеводородов изостроения при распаде карбоний ионов нормального строения. Реакции распада эндотермичны.
4. Присоединение карбоний иона к олефинам и ароматическим углеводородам.
Эти реакции можно рассматривать, как обратные реакции распада. Поэтому характер изменения теплового эффекта противоположен реакции распада, то есть эти реакции экзотермичны.
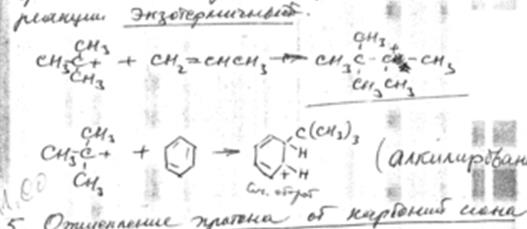
5. Отщепление протона от карбоний иона и передача протона молекуле олефина.

Эта реакция направлена на образование из первичных карбоний ионов вторичных, а затем третичных.
6. Отрыв гидрид иона от молекулы углеводорода. Активность карбоний иона в реакции отрыва гидрид иона также снижается в ряду:
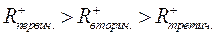
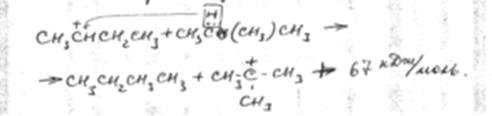
Несколько слов о сырье каталитического крекинга и катализаторах.
Превращения углеводородов различных классов в каталитическом крекинге.
При каталитическом крекинге протекает целый ряд различных реакций. Наряду с расщеплением имеют место реакции изомеризации, алкилирования, полимеризации, гидрирования, деалкилирования.
Рассмотрим главные реакции основых классов углеводородов, входящих в состав сырья каталитического крекинга.
1. Парафиновые углеводороды.
Условием образования карбоний иона, по-видимому, нужно считать термический распад части молекул в начальной стадии. Образующиеся олефины присоединяют протоны, находящиеся катализаторе, и превращаются в карбоний ион.
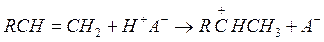
Затем образовавшийся ион карбония отрывает гидрид ион от молекулы парафинового углеводорода:
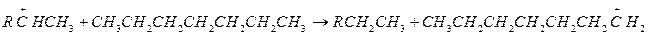
Далее реакция протекает по цепному механизму. Для образовавшегося первичного карбоний иона существует два пути превращения:
1. β-распад.
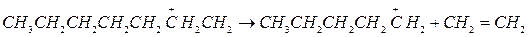
Однако, высокая скорость изомеризации ионов приводит к тому, что распад первичного карбоний иона осуществляется незначительно, выход этилена мал.
2. Изомеризация происходит как путем перемещения гидрид-иона, так и перемещением метил-иона (об этом уже говорилось раньше).
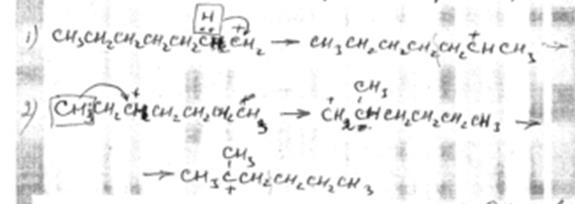
Далее образовавшиеся ионы претерпевают β-распад. Изомеризация с перемещением гидрид-иона дает продукты нормального строения, а изомеризация с перемещением метил-иона дает продукты изостроения.
Как уже говорилось, тепловой эффект реакций изомеризации положителен (экзотермичная), а тепловой эффект реакций расщепления (β-распада) – отрицателен, поэтому создаются благоприятные энергетические условия для протекания этих реакций. Чередование этих реакций продолжается до образования карбоний ионов с числом углеродных атомов 3-5. Тепловой эффект изомеризации этих небольших ионов уже не компенсирует затрат тепла на расщепление. Поэтому карбоний ионы с числом углеродных атомов, равных 3-5 после изомеризации отрывают гидрид-ион от молекулы исходных углеводородов
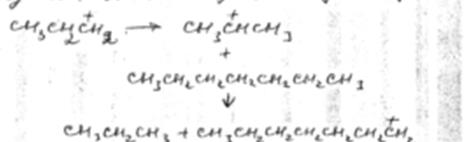
Затем весь цикл реакций повторяется.
Обрыв цепи происходит при встрече положительно заряженного иона карбония (карбкатионы) с анионом катализатора. 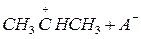
Первая стадия – отрыв гидрид иона от парафинового углеводорода – протекает быстрее в том случае, если гидрид ион отрывается от третичного углеродного атома. Поэтому скорость крекинга разветвленных углеводородов выше, чем нормальных. Кроме того, и распад ионов идет легче с отщеплением третичных карбоний-ионов. В результате в продуктах распада нормальных парафинов с числом угл-родных атомов четыре и более преобладают парафины.
Скорость каталитического крекинга алканов на один-два порядка выше скорости их термического крекинга.
|
|
|
|
|
Дата добавления: 2015-06-25; Просмотров: 3931; Нарушение авторских прав?; Мы поможем в написании вашей работы!